
| A. | 构造原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | A l、Mg分别与稀氢氧化钠溶液反应 | 比较铝、镁的金属性强弱 |
| B | 2mol/LNaOH溶液滴加到1mol/LCaCl2溶液中,产生白色沉淀 | 比较钠、钙的金属性强弱 |
| C | 用盐酸和碳酸钙反应制取的CO2直接通入Na2SiO3溶液中,溶液变浑浊 | 比较碳、硅的非金属性强弱 |
| D | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 气体 | 溶液 | 现象 | 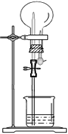 |
| A | NH3 | H2O含酚酞 | 红色喷泉 | |
| B | Cl2 | 饱和食盐水 | 无色喷泉 | |
| C | HCl | H2O含石蕊 | 红色喷泉 | |
| D | SO2 | NaOH溶液 | 无色喷泉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
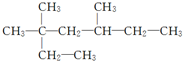 的命名正确的是( )
的命名正确的是( )| A. | 2,4-二甲基-2-乙基己烷 | B. | 3,5,5-三甲基庚烷 | ||
| C. | 3,3-二甲基-5-甲基庚烷 | D. | 3,3,5-三甲基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 浓硫酸可以干燥H2、NH3、CO2等气体 | |
| D. | SO2的漂白原理与次氯酸相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com