
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
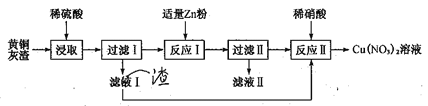
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
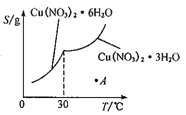
【答案】Fe2O3+6H+=2Fe3++3H2O加入过量的Zn会使最终所得的Cu(NO3)2溶液中含有杂质Zn2+、Fe2+3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O温度过高硝酸会挥发及分解,温度过低则反应速率较慢向溶液A中加入适量硝酸,将溶液A蒸发浓缩,冷却到30℃以上,过滤。
【解析】黄铜灰中加入稀硫酸,稀硫酸可Zn、CuO、ZnO、FeO、Fe2O3反应,滤渣1为铜和少量的SiO2,滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入适量锌粉,锌粉可与Cu2+、H+反应生成铜和氢气,滤渣2主要为铜,将滤渣1和滤渣2用稀硝酸溶解并过滤除去SiO2后,即可得到Cu(NO3)2溶液,再将溶液蒸发、浓缩并结晶,即可得到Cu(NO3)2·3H2O;
(1)浸取时,Fe2O3与稀硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
(2)滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入锌粉是为了置换出铜,如果Zn粉过量,则Cu中混合Fe和Zn,制得的Cu(NO3)2溶液不纯;
(3)滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入适量锌粉,锌粉可与Cu2+、H+还原生成铜和氢气,过虑后滤渣2主要为铜,滤液II中含有的金属阳离子主要有Cu2+、Fe2+;
(4)反应II是稀硝酸溶解Cu,生成Cu(NO3)2和NO,发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;反应II加热是为了提高反应速率,但温度过高
硝酸会挥发及分解,温度过低则反应速率较慢;
(5)A点对应的溶液为高温度下Cu(NO3)2的稀溶液,需要向溶液A中加入适量硝酸抑制Cu2+的水解,同时将溶液A蒸发浓缩,冷却到30℃以上,待析出晶体后再过滤,即可获取Cu(NO3)2·3H2O。


科目:高中化学 来源: 题型:
【题目】将氨水缓缓地滴入盐酸中至中性,下列有关的说法正确的是
①盐酸过量②氨水过量③恰好完全反应④c(NH4+)=c(Cl-)⑤c(NH4+)<c(Cl-)
A.①⑤ B.③④ C.②⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国营养学会修订颁布的“每日膳食营养素供给量”将硒(Se)列为15种每日膳食营养素之一,提出一个成年人每天对硒的适宜摄入量是50 ~250μg。回答下列有关问题:
(1) Se 原子的价电子排布式为_______,基态78 Se 原子中,核外存在______对自旋方向相反的电子。
(2)碱金属的硒化物溶液能够溶解硒,生成多硒化合物(M2Sex)。如多硒化钠Na2Se8,该物质中,化学键类型是________,Se原子之间形成的空间构型为_________________。
(3)As、S在元素周期表中均与Se 相邻,其氢化物分别是AsH3、H2Se和H2S其氢化物的稳定性强弱顺序为______________________。
(4)SeCl2和BeCl2均为1:2组成的分子,SeCl2中Se的轨道杂化类型是_______,BeCl2中Be的轨道杂化类型是_________________。
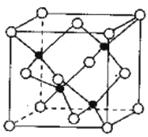
(5)Zn与Se同周期,S与Se同主族。由Zn与S形成的ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS晶胞结构如图所示,黑球代表的原子在晶胞内,白球代表的原子除在顶点外,其余的原子在晶胞_________ (填“内部”“棱上”或“面心”),若该晶体的密度为ρg·㎝-3,阿伏加德罗常数为NA mol-1,则立方晶胞的棱长=_____㎝(用含p、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 氯化钠与浓硫酸混合加热:H2SO4(浓)+2Cl-![]() SO42- + 2HCl↑
SO42- + 2HCl↑
B. 过量的硫化钠溶液与氯化铁溶液反应:2Fe3++S2-=2Fe2++ S↓
C. 碳酸氢铵溶液与足量NaOH溶液混合后加热:NH4++HCO3-+2OH-![]() CO32-+NH3↑+2H2O
CO32-+NH3↑+2H2O
D. 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水酸化将改变海水化学的种种平衡,使依赖于化学环境稳定性的多种海洋生物乃至生态系统面临巨大威胁。用生石灰中和法阻止海水酸化是人们的一种设想。生石灰属于( )
A.酸 B.碱 C.盐 D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铍元素及其化合物的性质的推测正确的是( )
A.铍原子的半径大于硼原子的半径
B.相同条件下,单质铍与酸反应比与单质锂与酸反应剧烈
C.氢氧化铍的碱性比氢氧化钙的碱性强
D.单质铍能与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小a kJ·mol-1
D.增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com