
分析 (一)(1)根据电子守恒和原子守恒来配平化学方程式;
(2)氧化还原反应中,化合价升高元素失去电子,化合价降低元素对应的产物是还原产物,根据化学方程式来计算反应转移电子的量;
(3)根据化学方程式中硝酸根离子和金属铝之间的关系来计算回答;
(二)(1)NaCN为强碱弱酸盐,水解生成HCN和氢氧化钠;
(2)氰化钠与双氧水发生氧化还原反应生成碳酸氢钠和氨气;
(3)HCN酸性非常弱,依据强酸制备弱酸原理分析解答.
解答 解:(一)(1)氯元素化合价共升高了3价,两氮元素化合价共降低了10价,根据得失电子守恒,则需要转移电子30mol,所以金属铝的前面系数是10,硝酸根前面系数是6,氮气前面系数是3,根据原子守恒配平氢原子和氧原子即可,即6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-,
故答案为:6;10;18;3;10;6;
(2)氧化还原反应中,化合价升高元素Al失去电子,化合价降低的N元素对应的产物N2是还原产物,根据化学方程式可知,生成3mol的氮气转移电子是30mol,当生成1mol氮气时,转移电子是10mol,所以转移电子数为:10NA,故答案为:Al;N2;10NA;
(3)因为含氮0.3mol的废水中的NO3-的物质的量为0.3mol,由化学方程式可知,0.3mol的硝酸根离子消耗金属铝的物质的量为0.5mol,故答案为:0.5mol;
(二)(1)NaCN为强碱弱酸盐,水解生成HCN和氢氧化钠,离子方程式:CN-+H2O?HCN+OH-;
故答案为:CN-+H2O?HCN+OH-;
(2)氰化钠与双氧水发生氧化还原反应生成碳酸氢钠和氨气,化学方程式:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
(3)HCN酸性非常弱,酸化的高锰酸钾中含有大量氢离子,依据强酸制备弱酸原理能生成大量有毒的HCN,方程式:NaCN+H2SO4=Na2SO4+HCN;
故答案为:不能;NaCN+H2SO4=Na2SO4+HCN.
点评 本题考查了氧化还原反应、盐类的水解,明确氧化还原反应得失电子守恒规律、盐类水解规律是解题关键,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
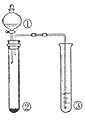 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2S | CuSO4 | 酸性:H2S>H2SO4 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子化合物熔沸点较高、共价化合物熔沸点较低 | |
| B. | 全部由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 离子半径:Na+>Mg2+>Al3+>F- | |
| D. | 熔点:金刚石>NaCl>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
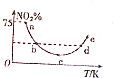 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )| A. | 10s内,图中a点对应的N2O4反应速率为0.01mol•L-1•s-1 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | c点前后平衡移动的方向相反 | |
| D. | e点对应的容器中气体颜色最深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从碘水中萃取碘单质,可用苯做萃取剂 | |
| B. | 用加热分解的方法可以区别碳酸钠和碳酸氢钠两种固体 | |
| C. | 配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒 | |
| D. | 氨气喷泉实验时,烧瓶必须干燥才可收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与水反应时,转移电子的数目为2 NA | |
| B. | 标准状况下,22.4 L水中含有水分子的数目为NA | |
| C. | 14 g N2中含有电子的数目为7 NA | |
| D. | NA个一氧化碳分子和0.5 molCH4的质量比为7:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com