
【题目】由NO2、O2和熔融NaNO3组成的燃料电池如图所示。在该电池工作过程中石墨Ⅰ电极产生一种气态氧化物Y。下列说法正确的是( )

A.Y可能为NO B.电流由石墨Ⅰ流向负载
C.石墨Ⅰ上发生还原反应 D.石墨Ⅱ上的电极反应:O2+2N2O5+4e-=4NO3-
科目:高中化学 来源: 题型:
【题目】铁及其化合物之间的相互转化可用下式表示:Fe2+![]() Fe3+
Fe3+![]() FeO42-(高铁酸根离子)。回答下列有关问题:
FeO42-(高铁酸根离子)。回答下列有关问题:
(1)Fe与过量盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可选用__________(填字母)。
a.Cl2 b.Fe c.Cu d.KMnO4
(2)如下化学方程式中:Fe2O3+3NaClO+4KOH=2K2FeO4(高铁酸钾)+3NaCl+2H2O,还原剂是______________,具有__________性。
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是___________、__________。
(4)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
①请你填出该同学实验中出现以下现象时应得出的结论:
实验现象 | 试管Ⅰ | 试管Ⅱ | 结论 |
a | 褪色 | 不变红 | ___ |
b | 不褪色 | 变红 | ___ |
c | 褪色 | 变红 | ___ |
②能不能将KMnO4和KSCN滴入到同一试管中进行验证,为什么?试进行解释:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
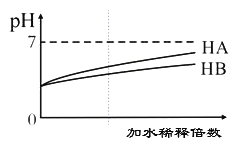
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是 __________________;
②确定分子式:如图是该有机物的质谱图,则其相对分子质量为 ____;分子式为 _____;
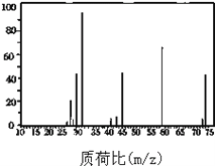
③结构式的确定:经测定,该有机物在核磁共振氢谱中出现四个峰,其氢原子个数比为6∶1∶2∶1;该有机物与金属钠反应产生氢气;则A的结构简式为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
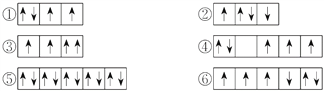
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】试题分析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
解析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。
【题型】综合题
【结束】
18
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )

A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
该气体无色,说明其中不含NO2;气体通过浓硫酸体积减小,说明其中有NH3;气体通过足量Na2O2后显红棕色,说明其中含有CO2和NO,故不含O2;最后通入水中无气体剩余,说明其中不存在N2,选项B正确,故答案为B。
【题型】单选题
【结束】
19
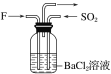
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。

请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4和CO2都能与H2O形成笼状结构的水合物晶体,CH4与H2O形成的水合物俗称“可燃冰”。
(1)“可燃冰”晶体中平均每46个H2O分子构建8个笼,其中6个笼分别容纳1个CH4分子,另外2个笼分别容纳1个H2O分子,则“可燃冰”平均组成可表示为________(填化学式)。
(2)已知:
CO2(g)+nH2O(l)=CO2·nH2O(s) △H=-57.98kJ·moI-1
CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49kJ·mol-1
反应CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)的△H=________kJ·mol-1
(3)科学家提出用CO2“置换”CH4开采海底“可燃冰”的设想,提出该设想的理论依据是________。
(4)图中显示,CO2·nH2O的生产速率明显大于 CH4·nH2O释放出的速率,其原因是________。

(5)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

①反应(i)的化学方程式为________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.标准状况下,22.4L苯所含有的分子数为NA
B.1mol羟基中含有的电子数为10NA
C.14g C2H4和C3H6混合气体含有的原子数为3NA
D.1L0.1mol/L的醋酸溶液中含有H+个数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com