
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol
D
【解析】
试题分析:A、CuFeS2中铁元素的化合价为+2价,反应物Fe3+的化合价为+3价,生成物中Fe2+的化合价为+2价,所以不是所有铁元素均被还原,故A错误;B、依据反应中元素化合价的变化硫元素化合价从-2变化为0价被氧化为S,氧化产物是S,还原产物是Fe2+,铜离子反应前后化合价不变,所以氧化剂是Fe3+,氧化产物是S,故B错误;C、由CuFeS2+4Fe3+=Cu2++5Fe2++2S可知,生成2molS转移电子为4mol,则获得单质硫x mol转移电子为2x mol,故C不正确;D、由CuFeS2+4Fe3+==Cu2++5Fe2++2S,生成单质硫x mol时,生成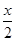 molCu2+
molCu2+  x molFe2+ 消耗2x molFe3+ ,余下(y mol-
x molFe2+ 消耗2x molFe3+ ,余下(y mol-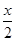 mol-
mol-
 x
mol)=(y-3x)molFe3+ ,则原Fe3+的总物质的量为(y-3x+2x) mol=(y-x) mol,D正确,选D。
x
mol)=(y-3x)molFe3+ ,则原Fe3+的总物质的量为(y-3x+2x) mol=(y-x) mol,D正确,选D。
考点:氧化还原反应;氧化还原反应的计算


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中硫元素被氧化,所有铁元素均被还原 | B、氧化剂是Fe3+,氧化产物是Cu2+ | C、反应中转移电子的物质的量为xmol | D、反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y-x)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com