
| 催化剂 |
| 高温、高压 |
| 催化剂 |
| 高温、高压 |


科目:高中化学 来源: 题型:
| A、△H1>△H3>△H2 |
| B、△H1<△H3<△H2 |
| C、△H1>△H2=△H3 |
| D、△H1=△H2<△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


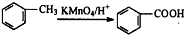
| 浓硫酸 |
| 浓硫酸 |
| 催化剂 |
| 390℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.查看答案和解析>>
科目:高中化学 来源: 题型:
3- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C | - 3 |
| C | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.| A | B | C | D | |
| 应加试剂 | ||||
| 所除杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com