
| 实验目的 | 实验方法 | |
| A. | 从食盐水中获得食盐 | 过滤 |
| B. | 将海水淡化为可饮用水 | 蒸发 |
| C. | 分离水和碘的四氯化碳溶液 | 分液 |
| D. | 分离碳酸钠溶液和乙酸乙酯 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.食盐易溶于水,无法通过过滤分离;
B.通过蒸馏海水可以获得淡水,蒸发海水的目的是获得食盐;
C.需要通过萃取方法分离水和四氯化碳溶液;
D.乙酸乙酯和碳酸钠溶液分层,应该是通过分液分离.
解答 解:A.从食盐水中获得食盐,需要通过蒸发操作完成,故A错误;
B.将海水淡化为可饮用水,需要通过蒸馏完成,蒸发海水的目的是获得食盐,故B错误;
C.水和碘的四氯化碳溶液分层,可通过分液操作分离,故C正确;
D.碳酸钠溶液和乙酸乙酯的混合液分层,需要通过分液分离,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯方法、物质的性质、性质差异为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
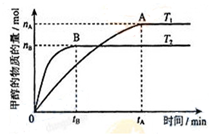 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水和溴化钾溶液反应:Cl2+2Br-═2Cl-+Br2 | |
| B. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸和氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 铝和氢氧化钠溶液反应:Al+2H2O+OH-═AlO2-+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
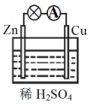
| A. | Zn为负极,Cu为正极 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 正极反应式为Cu-2e-Cu2+ | D. | 原电池的反应本质是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碳酸钙的状态 | 盐酸的浓度 | 反应的温度 | |
| A. | 块状 | 1 mol/L | 25℃ |
| B. | 块状 | 6 mol/L | 40℃ |
| C. | 粉末 | 1 mol/L | 25℃ |
| D. | 粉末 | 6 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
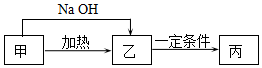 甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.
甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是天然气的主要成分,能发生取代反应,但不能发生氧化反应 | |
| B. | 实验室中,可用金属钠检验乙醇中是否含有水 | |
| C. | 只用水无法鉴别苯、乙酸和四氯化碳 | |
| D. | 植物油不能用于萃取溴水中的溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com