
| 1.08g |
| 0.01mol |
| 1.44g |
| 18g/mol |
 ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X基态原子中成对电子与未成对电子数之比为4:3 |
| Y | Y基态原子L层电子数是K层的3倍 |
| Z | Z元素在自然界中存在质量数为35和37的两种核素 |
| W | W为一种常见金属,能形成多种氧化物,其中有一种具有磁性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
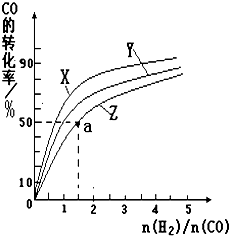 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
| OH- |
| H+ |
| OH- |
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中提取氯化钠的过程涉及化学反应 |
| B、从海带中提取碘单质的过程涉及置换反应 |
| C、从海水中提取溴单质的过程涉及氧化还原反应 |
| D、海水中含有氯化钠等多种氯化物;除了氯,海水中溴的储量也很高,溴也被称为“海洋元素” |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、向Ca(OH)2溶液中通人CO2至过量 |
| B、在盐酸和硫酸的混合溶液中加入Ba(OH)2溶液至过量 |
| C、在水玻璃和烧碱混合溶液中加入盐酸至过量 |
| D、在Ba(OH)2溶液中加入氯化铝溶液至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com