
| A. | 足量的SO2通入氨水中:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| B. | SO2通入溴水中:Br2+SO2+2H2O═2H++SO42-+2HBr | |
| C. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 酸雨久置pH变小:2H2SO3+O2═4H++2SO42- |
分析 A.反应生成亚硫酸氢铵;
B.发生氧化还原反应生成硫酸和HBr,HBr为强酸;
C.发生氧化还原反应生成硫酸钙;
D.亚硫酸被氧化生成硫酸,酸性增强,pH减小.
解答 解:A.足量的SO2通入氨水中的离子反应为SO2+NH3•H2O═NH4++HSO3-,故A错误;
B.SO2通入溴水中的离子反应为Br2+SO2+2H2O═4H++SO42-+2Br-,故B错误;
C.少量SO2通入漂白粉溶液中的离子反应为SO2 +3ClO-+Ca2++H2O=CaSO4↓+Cl-+2HClO,故C错误;
D.酸雨久置pH变小的离子反应为2H2SO3+O2═4H++2SO42-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
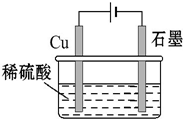
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一段时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
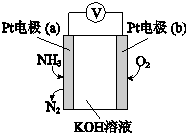
| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极b移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据右图回答下列问题:
根据右图回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com