
| A、1 mol 硫酸钾中阴离子所带电荷数为NA |
| B、28g以任意比组成的CO与N2混合气体中含有2NA个原子 |
| C、5.6g Fe与足量盐酸反应,转移的电子数为0.3NA |
| D、将0.1mol氯化钠溶于1L水中,所得溶液浓度为0.1mol?L-1 |
| m |
| M |
| m |
| M |
| m |
| M |
| 28g |
| 28g/mol |
| m |
| M |


科目:高中化学 来源: 题型:
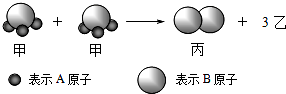 如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )| A、1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、摩尔质量关系为:2M (甲)=M (乙)+M (丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气在氧气中燃烧 |
| B、锌和稀硫酸反应制取氢气 |
| C、盐酸和氢氧化钠的中和反应 |
| D、焦炭在高温下与水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2 (g) |
| B、CO(g) |
| C、C8H18 (l) |
| D、CH4(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 g CH4中含有的电子数 |
| B、100 mL 1 mol/L H2SO4中含有的H+数 |
| C、24 g Mg与足量稀盐酸反应转移的电子数 |
| D、标准状况下,22.4 L CO气体中含有的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
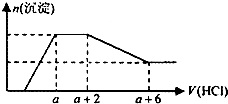 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )| A、原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32- |
| B、反应最后形成的溶液中的溶质为NaCl |
| C、原溶液中一定含有Na2SO4 |
| D、原溶液中含有CO32-与AlO2- 的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、向含有0.4 mol FeBr2的溶液中通入0.1 mol Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CO32-)=0.01mol?L-1,c(NH4+)>c(SO42-) |
| B、如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
| C、一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ |
| D、一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、k+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com