
| A. | 氢处于第一周期 | B. | 氯处于第ⅦA族 | ||
| C. | 硅与碳处于同一主族 | D. | 第三周期元素全部是金属元素 |
分析 A、H原子的质子数为1,原子结构中只有一个电子层;
B、Cl原子的质子数为17,原子结构中最外层电子数为7;
C、硅与碳最外层电子数相等,都是4个,都处于第ⅣA族;
D、第三周期元素有Na、Mg、P、S、Cl等元素.
解答 解:A、因H原子的质子数为1,原子结构中只有一个电子层,则位于元素周期表中的第一周期,故A正确;
B、因Cl原子的质子数为17,原子结构中最外层电子数为7,则处于VⅡA族,故B正确;
C、硅与碳最外层电子数相等,都是4个,都处于第ⅣA族,故C正确;
D、第三周期元素有Na、Mg、P、S、Cl等元素,Na、Mg等属于金属元素,P、S、Cl等属于非金属元素,故D错误;
故选D.
点评 本题考查原子的结构和元素在元素周期表中的位置,明确短周期中的元素及元素的质子数、元素的分类是解答本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LHCl溶于水后溶液中含有NA个HCl分子 | |
| B. | 常温常压下,33.6LCl2中含有1.5NA个Cl2分子 | |
| C. | 1.8g的NH4+离子中含有NA个电子 | |
| D. | 将0.1mol氯化铝溶于1L水中,所得溶液含有0.1NAAl3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:催化剂条件下通入H2 | |
| B. | 乙醇中含有乙酸杂质:加入 碳酸钠溶液,分液 | |
| C. | FeCl3溶液中含有CuCl2杂质:加入过量铁粉,过滤 | |
| D. | CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 向KI溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油分馏后得到的汽油、柴油、煤油等都是纯净物 | |
| B. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”才能提高空气质量 | |
| C. | 太阳能电池板中的硅元素在元素周期表中处于金属与非金属的交界位置 | |
| D. | 煤经过气化和液化两个物理变化,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、H+、Cl- | B. | Cl-、CO32-、OH- | C. | K+、H+、Cl- | D. | K+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
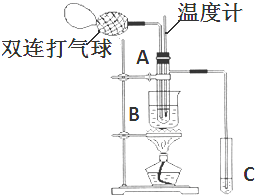
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com