
(6分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
| | | | | | |
| | C | N | O | F | |
| | Si | P | S | Cl | |
| | Ge | As | Se | Br | |
| | Sn | Sb | Te | I | |
| | Pb | Bi | Po | At | |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:阅读理解
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| CO | 2- 3 |
查看答案和解析>>
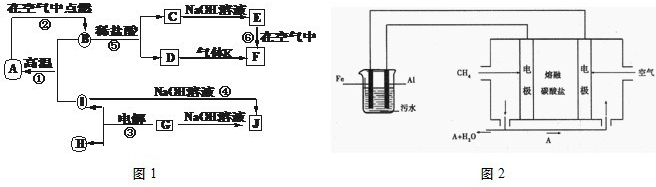
科目:高中化学 来源: 题型:阅读理解
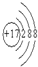
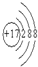
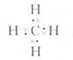
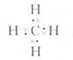
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
|
|
|
|
|
|
|
|
| C | N | O | F |
|
|
| Si | P | S | Cl |
|
|
| Ge | As | Se | Br |
|
|
| Sn | Sb | Te | I |
|
|
| Pb | Bi | Po | At |
|
(1)非金属性最强的元素是 ,常用来做半导体材料的元素是 ;
(2)形成化合物种类最多的元素是 ,写出该元素最高价氧化物的化学式 ;
(3)根据元素周期律,请你预测(填“>”或“<”):酸性强弱H3AsO4 H3PO4,气态氢化物的稳定性AsH3 H2Se。
查看答案和解析>>
科目:高中化学 来源:2014届福建省四地六校高一下学期第二次联考化学试卷(解析版) 题型:填空题
(6分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
|
|
|
|
|
|
|
|
|
C |
N |
O |
F |
|
|
|
Si |
P |
S |
Cl |
|
|
|
Ge |
As |
Se |
Br |
|
|
|
Sn |
Sb |
Te |
I |
|
|
|
Pb |
Bi |
Po |
At |
|
(1)非金属性最强的元素是 ,常用来做半导体材料的元素是 ;
(2)形成化合物种类最多的元素是 ,写出该元素最高价氧化物的化学式 ;
(3)根据元素周期律,请你预测(填“>”或“<”):酸性强弱H3AsO4 H3PO4,气态氢化物的稳定性AsH3 H2Se 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com