
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成原理:CO(NH2)2+H2O2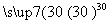 CO(NH2)2·H2O2。
CO(NH2)2·H2O2。
请回答下列问题:
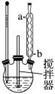
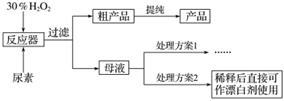
(1)流程图中反应器的装置如图所示,推测该反应的加热方式是______________________;回流管中冷水流从____________口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是__________________________。
(2)母液处理方案1可以是______________(用文字表达)。若欲从母液中分离出H2O2和尿素,可采用的操作是______(选填序号)。
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品2.000 g,溶解,在250 mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol·L-1的硫酸,然后用0.100 0 mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00 mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式:______MnO +______H2O2+________________________
+______H2O2+________________________
H+===______Mn2++______H2O+______。
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量________。(填“偏高”、“偏低”或“不变”)
③根据滴定结果,可确定产品中活性氧的质量分数为________________________________________________________________________
________________________________________________________________________。
答案 (1)30 ℃水浴 b 过氧化氢能氧化铁、铝,生成的金属离子能催化过氧化氢的分解
(2)循环利用 B
(3)①2 5 6 2 8 5O2↑ ②偏高
③16%(或0.16)
解析 (1)由题意知,反应温度为30 ℃,加热时应采用30 ℃水浴加热,回流冷凝管中水的流向均为下进上出。
(2)母液中还残留CO(NH2)2和H2O2,因此可以循环使用,两者均易溶于水,盐析、分液无法分离,可以采用蒸馏的方法分离。由于H2O2易分解,采用减压蒸馏分离。
(3)MnO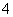 作氧化剂,则H2O2被氧化为O2,缺项为O2,由电子守恒配平得2MnO
作氧化剂,则H2O2被氧化为O2,缺项为O2,由电子守恒配平得2MnO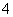 ~5H2O2,则H2O2的质量分数m=
~5H2O2,则H2O2的质量分数m=
 ×100%=34%,活性氧的质量分数为16%。由于滴定前滴定管尖嘴处有气泡,滴定后消失,则计算时标准液的体积偏大,测得的活性氧含量偏高。
×100%=34%,活性氧的质量分数为16%。由于滴定前滴定管尖嘴处有气泡,滴定后消失,则计算时标准液的体积偏大,测得的活性氧含量偏高。


科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.通过煤的干馏可以获得焦炭
B.煤液化后可以得到甲醇
C.从萃取分液后溴的四氯化碳溶液中提取溴可以用分馏的方法
D.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是_________________________________________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O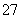 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________和________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是( )
A.氨气极易溶解于水的性质可以解释氨气的喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
D.氨水的热稳定性强可以解释实验室中用加热氨水的方法制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氢硫酸、亚硫酸、硫酸的说法中正确的是 ( )
A它们都有酸性,电离出的H+有弱氧化性
B它们都是酸,彼此之间不发生反应
C亚硫酸易分解放出SO2,所以它是挥发性酸
D在空气中放置,它们都会因氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下可实现下图所示物质之间的变化
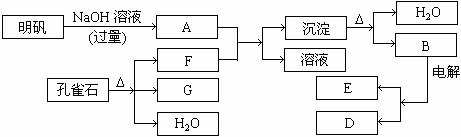
请填写以下空白:
(1)孔雀石的主要成份是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是 。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式 。
(3)图中所得G和D都为固体混合后在高温下可发生反应写出该反应化学方程式 。
(4)每生成1mol D同时转移的电子为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现

 ①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
A.两个反应都是置换反应 B.据反应条件无法判断反应是否吸热
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com