
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 单质硅是制光导纤维的材料 | |
| C. | 粗硅制备高纯度单质硅不涉及氧化还原反应 | |
| D. | 硅能与氢氟酸反应,则硅可以与盐酸反应 |
科目:高中化学 来源: 题型:选择题
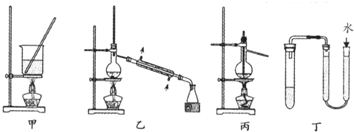
| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-3e一═Fe3+ | B. | Fe2+十20H-═Fe(OH)2 | ||
| C. | 2H20+02+4e-═40H- | D. | 4Fe(OH)2+2H20+02═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3,4-二甲基-4乙基-庚烷
3,4-二甲基-4乙基-庚烷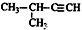 3-甲基-丁炔
3-甲基-丁炔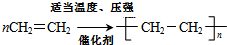 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com