
【题目】从海水中提取溴的工业流程如图:
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是 。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数及相应物质:
口Br2 + 口CO32-![]() 口BrO3-+ 口Br-+ 口
口BrO3-+ 口Br-+ 口
(4)上述流程中吹出的溴蒸气, 也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏,写出溴与二氧化硫水溶液反应的化学方程式: 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是 。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
【答案】(1)富集溴元素;(2)C;(3)3;3;1;5;3;CO2;
(4)SO2+Br2+2H2O═2HBr+H2SO4;(5)BD。
【解析】
试题分析:(1)海水中溴元素的浓度低,因此II的作用是富集溴元素;(2)溴单质易挥发的液体,因此通入热空气或水蒸气的作用利用溴单质的挥发性,故选项C正确;(3)根据化合价的升降配平,即3Br2+CO32-→BrO3-+5Br-+口,利用反应前后所带电荷数守恒,配平CO32-,即为3Br2+3CO32-→BrO3-+5Br-+口,根据元素守恒和原子个数守恒,即为3Br2+3CO32-=BrO3-+5Br-+3CO2↑;(4)Br2具有强氧化性,SO2以还原性为主,其反应方程式为:SO2+Br2+2H2O═2HBr+H2SO4;(5)溴单质易溶于有机溶剂,选择萃取剂的原则:①被萃取物质不能和萃取剂发生反应,②被萃取的物质在萃取剂的溶解度远远大于在原溶剂中的溶解度,③萃取剂和原溶剂不能互溶,故选项BD正确。


科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
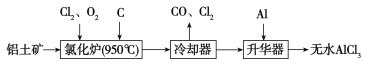
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是
______________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为
_______________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和![]() 溶液pH<7。
溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
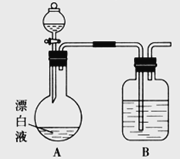
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式________。
③若打开分液漏斗活塞向烧瓶中加入饱和![]() 溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加
溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加![]() 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,37Cl和35Cl是氯的两种同位素,下列说法正确的是()
A. 35Cl原子所含质子数为18
B. ![]() mol的H35Cl分子所含中子数约为6.02×1023
mol的H35Cl分子所含中子数约为6.02×1023
C. 3.5 g的35Cl2气体的体积为2.24 L
D. 35Cl2气体的摩尔质量为70
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在气态时与相同状况下的H2的密度之比为30∶1,又知12.0 g该有机物与足量钠反应放出0.2 g H2,且不能发生银镜反应,符合条件的有机物可能有( )
A.2种 B.3种 C.4种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl、S 2-
B.酸性溶液中可能大量存在Na+、ClO、SO42-、I
C.弱碱性溶液中可能大量存在Na+、K+、Cl、HCO3
D.中性溶液中可能大量存在Fe3+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N﹣N吸收167 kJ热量,生成1mol N≡N放出942 kJ。根据以上信息和数据,下列说法正确的是
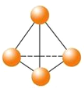
A.N4与N2互为同分异构体
B.1mo1N4气体转变为N2将吸收882kJ热量
C.N4(g)=2N2(g) ΔH = - 882KJ
D.P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用下图装置探究氨的催化氧化。

(1)浓氨水中存在多种形式的氢键,用氢键表示式写出浓氨水中存在的所有氢键_________________。
(2)氨催化氧化的化学方程式为_____________________。
(3)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”)。
(4)三氧化二铬在反应中做催化剂。写出基态铬原子的核外电子排布式_________________;这样排布使整个体系能量最低,原因是 。
(5)若取消装置3,在装置4中仅观察到大量白烟,为保证在装置4中观察到红棕色气体,装置3应装入______________。
(6)为实现氨催化氧化,也可用装置5替换装置1,化合物X(一种)中存在的化学键类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下, NA个H2和O2的混合气体的体积约为22.4 L
B.1mol SiO2晶体中,含有2NA个Si—O键
C.0.1 mol Cl2溶解于一定体积的水中,转移电子数为0.2NA
D.标准状况下,11.2 L H2O所含分子数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com