
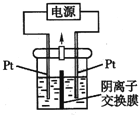
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-═IO3-+5I-+3H2O下列说法不正确的是( )
A. 右侧发生的电极方程式:2H2O+2e-═H2↑+2OH-
B. 电解结束时,右侧溶液中含有IO3-
C. 电解槽内发生反应的总化学方程式:![]()
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总反应不变
【答案】D
【解析】分析:左侧溶液变蓝色,生成I2,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,右侧放出氢气,右侧I-、OH-通过阴离子交换膜向左侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,据此解答。
详解:A.左侧溶液变蓝色,生成I2,左侧电极为阳极,右侧电极为阴极,阴极上氢离子得电子生成氢气,则右侧电极反应式为:2H2O+2e-=H2↑+2OH-,A正确;
B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,B正确;
C.左侧电极为阳极,电极反应为:2I--2e-=I2,同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故总的电极反应式为:KI+3H2O![]() KIO3+3H2↑,C正确;
KIO3+3H2↑,C正确;
D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O![]() 2KOH+I2+H2↑,电解槽内发生的总化学方程式发生变化,D错误;答案选D。
2KOH+I2+H2↑,电解槽内发生的总化学方程式发生变化,D错误;答案选D。


科目:高中化学 来源: 题型:
【题目】下列各项有机化合物的命名或分类正确的是( )
A.2,3﹣二甲基﹣2﹣乙基己烷
B.CH3CH2CH2Cl氯丙烷
C.![]() 属于芳香醇
属于芳香醇
D.![]() 属于芳香化合物
属于芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
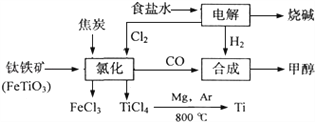
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式:_____________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJmol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJmol﹣1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H=___________________________。反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
(3)在上述产业链中,合成192t甲醇理论上需额外补充H2___________t(不考虑生产过程中物质的任何损失).
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工合成有机化合物H的路线可简单表示如图:  已知:F的核磁共振氢谱有四个峰,峰的面积比为1:1:3:3.
已知:F的核磁共振氢谱有四个峰,峰的面积比为1:1:3:3.
请回答下列问题:
(1)A的名称(系统命名)为;C中官能团的结构简式为 .
(2)G+F→H的反应类型为;H的结构简式为 .
(3)B→C的化学方程式为 .
(4)E→F的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式_______________________________。
Ⅱ.V、W、X、Y、Z是由四种短周期元素中的2种或3种组成的5种化合物,其中W、X、Z均由2种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素A和两种非金属元素B与C组成,其化学式构成为A(BC3)3 。它们之间的反应关系如下图:
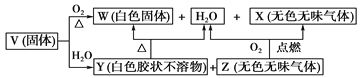
(1)写出物质W的一种用途:__________________________________________________。
(2)写出V与足量NaOH溶液反应的化学方程式:________________________________。
(3)将少量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为________________________________________________________________________。
(4)写出气体X的结构式__________。
(5)以Z为燃料,活性炭为电极,熔融碳酸盐(如熔融K2CO3)环境下制成燃料电池的负极反应式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
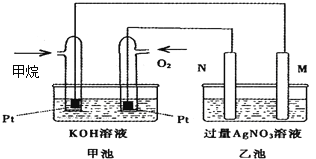
(1)M电极的材料是__________,其电极名称是_____________。
(2)N的电极反应式为____________________________,通入甲烷的电极反应式为______________________________________________,
(3)乙池总反应的化学方程式是_______________________________________________,
(4)在此过程中,乙池中某一电极析出金属银4.32g,甲池中理论上消耗氧气为_____mL(标准状况下),若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸是一种重要的有机二元酸,能够发生成盐反应、酯化反应、酰胺化反应等,并能与二元胺或二元醇缩聚成高分子聚合物等,是合成尼龙-66的原料,工业上环己醇用硝酸氧化可得到己二酸,是典型的氧化还原反应。
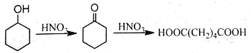 △H<0
△H<0
相关物理常数:
名称 | 相对分子质量 | 密度(20℃) g/cm3 | 熔点(℃) | 沸点(℃) | 溶解度S(g100g溶剂) | ||
水 | 乙醇 | 乙醚 | |||||
环己醇 | 100 | 0.96 | 25.2 | 161 | 可溶 | 易溶 | |
己二酸 | 146 | 1.36 | 151 | 265 | 可溶(S随温度降低而减小) | 易溶 | 微溶 |
I.己二酸粗产品的制备
操作步骤:装置C中加入50mL中等浓度的硝酸(过量),投入沸石,并逐一安 装装置A、装置B和温度计,磁力搅拌,将溶液混合均匀,并加热到80℃。用装置A滴加2滴环己醇,反应立即开始,温度随即上升到85~90℃,从装置A中小心地逐滴加入环己醇,将混合物在85-90℃下加热2-3 分钟,共加入1.000g环己醇。
请回答下列问题:
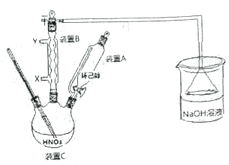
(1)反应需维持温度在85~90℃,最好采取______控温;试分析维持温度在85~90℃的原因:__________。
(2) 装置右侧烧杯中的NaOH 溶液的作用是:_______________。
II.己二酸粗产品的提纯及应用
操作流程:趁热倒出装置C 中的产品,在冷水中降温冷却,析出的晶体在布氏漏斗上进行抽滤,将晶体进行重结晶,再分别用3mL 冰水和乙醚洗涤己二酸晶体,继续抽滤,晶体再用3mL冰水洗涤一次,再抽滤。取出产品,干燥后称重,得干燥的己二酸0.860g。
请回答下列问题:
(3) 相比于普通过滤,抽滤的优点在于:_________
(4)在抽滤过程中,用冰水洗涤析出的己二酸晶体的原因:___________。
(5)该实验的产率为: _______% (结果保留3 位有效数字)
(6)工业上用己二酸与乙二醇反应形成链状高分子化合物,写出化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的表述正确的是
A.焰色反应是离子的特有性质
B.焰色反应是单质的特有性质
C.焰色反应是元素的特有性质
D.焰色反应是化合物的特有性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com