
| A、1L0.1mol?L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| B、25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| C、25℃时,BaCO3饱和溶液(Ksp=8.1×10-9):c(Ba2+)=c(CO32-)>c(H+)=c(OH-) |
| D、1.0 mol?L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| ||
| ||
| A、CO过量 |
| B、CO与铁矿石接触不充分 |
| C、炼铁高炉的高度不够 |
| D、CO与的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
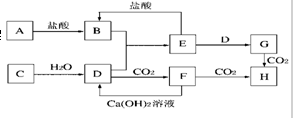
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于非金属性B>D,则A、B组成化合物的沸点高于A、D组成的化合物 |
| B、在C、B形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C、原子半径由大到小排列的是:C>D>E>B>A |
| D、B、C、E三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | Ba(OH)2的体积/mL | 溶液的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com