
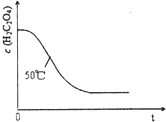
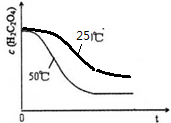
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
 ,故答案为:
,故答案为: ;
;

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、[Abc]5g18s2 |
| B、[Abc]8s28p1 |
| C、[Abc]7d18s2 |
| D、[Abc]6f18s2 |
| E、[Abc]6f18s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
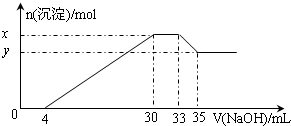 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A、原溶液中n(Mg2+):n(Al3+)=5:2 |
| B、原溶液的c(H+)=0.01 mol/L |
| C、x与y的差值为0.01 mol |
| D、原溶液中c(Cl-)=0.75mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、NOx、CO2、固体颗粒物同为大气污染物 |
| B、SO2对环境的主要影响是容易形成光化学烟雾,危害市民健康 |
| C、收集的酸雨在放置一段时间后pH会增大 |
| D、臭氧层是地球生命的保护伞,氟氯烃在破坏臭氧层时起到催化剂作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将足量CO通过灼热样品,冷却后称量,若固体质量减小,则含有Cu2O |
| B、将干燥的氢气通过灼热的样品,再通过无水硫酸铜,若无水硫酸铜变蓝,则含有Cu2O |
| C、取少量样品,加入稀硝酸,充分震荡后若观察到溶液呈蓝色,则含有Cu2O |
| D、取少量样品,加入稀硫酸,充分震荡后若观察到溶液呈蓝色,则含有Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
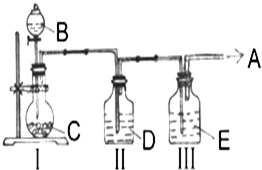 实验室中制取少量干燥纯净的气体A,可用如图装置
实验室中制取少量干燥纯净的气体A,可用如图装置查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com