
【题目】氢能是发展中的新能源,它的利用包括氯的制备、应用等环节。回答下列问题:
(1)氢气的制备
以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。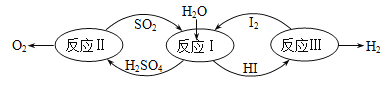
反应Ⅱ包含两步反应:
①H2SO4(1)=SO3(g)+H2O(g) ΔH=177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H=196kJ/mol
写出反应Ⅱ的热化学反应方程式__________
(2)氯气的应用
CO2加氢制备甲酸(HCOOH)可用于回收利用CO2。温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)![]() HCOOH(g) △H,化学平衡常数K=1
HCOOH(g) △H,化学平衡常数K=1
实验测得:v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当CO2的转化率为33.3%时,HCOOH的体积分数为_____(保留整数)。
②T1时,k逆=_________(用k正表示)。当升高温度至T2时,k逆=0.9k正,则△H____0(填“>”、“<"或“=”)。
③采用电还原法也可将CO2转化为甲酸根,用Sn为阴极、Pt为阳极,KHCO3溶液为电解液进行电解。CO2应通入______区(填“阳极”或“阴极”),其电极反应式为__________
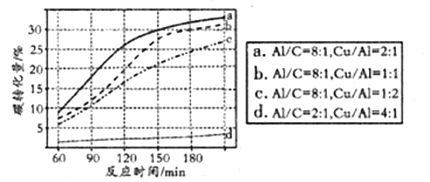
④可用NaHCO3代替CO2作为碳源加氢制备甲酸。向反应器中加入NaHCO3水溶液、A1粉、Cu粉,在300℃下反应。NaHCO3用量一定时,Al、Cu的用量对碳转化量影响结果如图。由图可知,曲线d相对其它三条曲线碳转化量变化不大的主要原因是__________,当碳转化量为30%时所采用的实验条件是____________。
 。
。
【答案】 2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=550kJ/mol 20% k正 > 阴极 2CO2+2e-+H2O=HCOO-+HCO3- Al的用量对碳转化量影响较大,曲线d中Al的用量少 150min,a180min,b
【解析】(1)反应①+②可以得出反应Ⅱ的热化学反应方程式:2H2SO4(1)=2SO2(g)+O2(g)+2H2O(g)△H=550kJ/mol
(2)①假设加入的二氧化碳和氢气均为1mol,CO2的转化率为33.3%,那么生成HCOOH0.33mol,剩余二氧化碳和氢气物质的量为0.667mol,HCOOH的体积分数为![]() ;
;
②已知v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),当达到化学平衡时v正=v逆,所以k正·c(CO2)·c(H2)=k逆·c(HCOOH),可得![]() ,又因为K=1,所以得出k正·=k逆;当升高温度至T2时,k逆=0.9k正,说明平衡正向移动,正向吸热,△H>0。
,又因为K=1,所以得出k正·=k逆;当升高温度至T2时,k逆=0.9k正,说明平衡正向移动,正向吸热,△H>0。
③CO2转化为甲酸根C原子的化合价降低,得到电子,应该在阴极发生反应,所以CO2应通入阴极,电极反应式为2CO2+2e-+H2O=HCOO-+HCO3-
④曲线d相对其它三条曲线碳转化量变化不大的主要原因是:Al的用量对碳转化量影响较大,曲线d中Al的用量少;通过图像可知,当碳转化量为30%时所采用的实验条件是:150min,a180min,b。


科目:高中化学 来源: 题型:
【题目】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___(填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______(填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
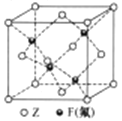
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1pm=1.0×10-12m)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
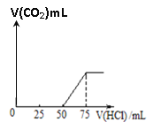
(1)A溶液中的溶质为_________(化学式),其物质的量之比是_______。
(2)通入CO2气体体积__________________(标准状况)。
(3)NaOH溶液的物质的量浓度______________________。
(4)假如通入的CO2气体为112mL, 画出得到溶液逐滴缓慢加入0.1mol/L的HCl溶液体积,与产生的CO2气体体积(标准状况)的关系图________________。(应体现关键点的数据)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
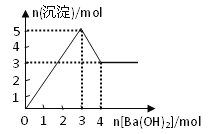
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体E,还能合成高分子化合物H,合成路线如下:
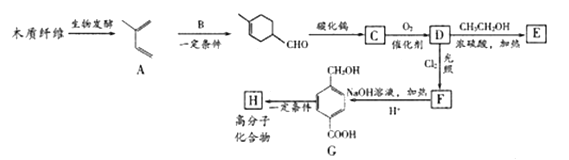
已知:
①
②![]()
回答下列问题:
(1)C的化学名称是__________,F所含官能团的名称是__________。
(2)G![]() H的反应类型是________。
H的反应类型是________。
(3)B的结构简式是____________
(4)F与NaOH溶液反应的化学方程式是___________
(5)符合下列条件的E的同分异构体共有_____种。
①分子中苯环上有两个对位取代基
②能发生银镜反应
③能和钠反应放出氢气,不与FeCl3溶液发生显色反应
(6)根据题给信息,写出以2-丁烯,HOOCCH=CHCOOH为原料,制备 的合成路线:________________(其它试剂任选)。
的合成路线:________________(其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用下图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。
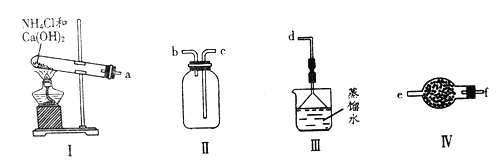
回答下列问题:
(1)写出利用装置I制取氨气的化学方程式_________________________________。
(2)按照气流方向,仪器连接的顺序:a→___________________________→d(用字母编号表示)。
(3)实验中装置III的作用________________。
(4)装置IV中仪器的名称为________,盛装的试剂为______________。
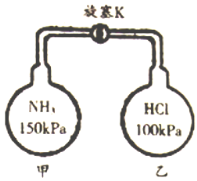
(5)在甲、乙玻璃容器中分别收集氨气和氯化氢,按下图装置进行实验。打开旋塞K,观察到的实验现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol/L,放出热量b kJ,B中C的浓度分别为
mol/L,放出热量b kJ,B中C的浓度分别为![]() mol/L,放出热量c kJ。请回答下列问题:
mol/L,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小: ![]() _____
_____![]() (填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 molA2和2 molB2,在500℃时达到平衡后C的浓度为![]() mol/L,则
mol/L,则![]() 、
、![]() 的关系为_____。
的关系为_____。
(5)能说明A中已达到平衡状态的是_____(填序号,有一个或多个选项符合题意)。
a. ![]() (C)=2
(C)=2![]() (B2) b. 容器内气体压强保持不变
(B2) b. 容器内气体压强保持不变
c. 容器中气体的平均相对分子质量不随时间而变化 d. 容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b. 适当升高温度 c. 增大B2的浓度 d. 选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com