
NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.一定条件下,1.5 mol H2和0.5 mol N2充分反应后可得到NH3的分子数为NA
B.足量的Fe与Cl2反应生成0.1 mol产物时失去的电子数为0.3NA
C.常温常压下,18 g H2O含有的电子总数为8NA
D.标准状况下,22.4 L的己烯中含有的分子数为NA
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择:
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH |
| 阴离子 | OH-、NO |
(1)若A、B的水溶 液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
①B的化学式为__________________________________________________________。
②A、B溶液混合加热反应的离子方程式_____________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为__________________________________________________________。
②经分 析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ________________________________________________________________________;
Ⅱ________________________________________________________________________。
③请用一简易方法证明上述溶液变黄的原因___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 ( )
( )
A.Al3+、Na+、NO 、Cl-
、Cl-
B.K+、Na+、Cl-、NO
C.K+、Na+、Cl-、AlO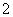
D.K+、NH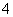 、SO
、SO 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是 ( )
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D. 得到2.54沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
科目:高中化学 来源: 题型:
若阿伏加德罗常数的数值为NA,下列说法中正确的 是( )
是( )
A.1.0 L 0.1 mol·L-1Na2S溶液中含有的S2-离子数小于0.1NA
B.1 mol Fe与过量的氯气反应,转移2NA个电子
C.2.24 L CO和CO2混合气体中含有0.1NA个碳原子
D.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成0.46NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
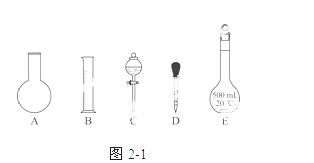
①如图21所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
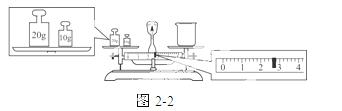
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图22。由图中可以看出,烧杯的实际质量为________g。
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用1 L 1.0 mol·L-1 NaOH溶液吸收0.8 mol CO2,所得溶液中的CO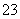 和HCO
和HCO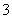 的物质的量浓度之比是( )
的物质的量浓度之比是( )
A.1∶3 B.2∶1
C.2∶3 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示 H,则
H,则 H=____________________;
H=____________________;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为________________________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________;
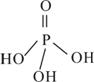
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)_____ Ni2+ + ____ H2PO2-+ _____ → ___Ni++______ H2PO3-+ ____
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:______________________________________________________;
原理上的不同点:______________________________________________________;
化学镀的优点:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+2CO2→2Na2CO3+O2 B.2Na2O2+2SO3→2Na2SO4+O2
C.2Na2O2+H2SO4→Na2SO4+H2O2 D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com