
【题目】下列实验装置符合实验目的的是( )
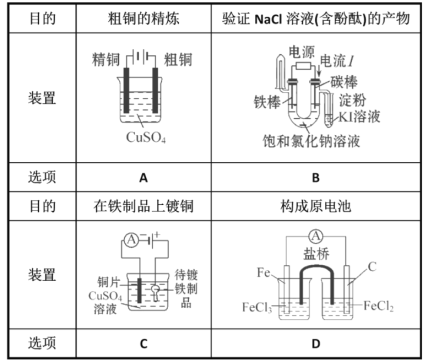
A. AB. BC. CD. D
【答案】B
【解析】
A.电解精炼粗铜时,粗铜作阳极,精铜作阴极,电解质溶液为可溶性的硫酸铜溶液,故A错误;
B.根据电流方向知,碳棒作阳极,铁棒作阴极,阳极上氯离子失电子生成氯气,氯气能和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,阴极上氢离子放电生成氢气,同时阴极附近生成氢氧根离子而使溶液呈碱性,无色酚酞试液遇碱变红色,所以该装置能检验氯化钠溶液的产物,故B正确;
C.电镀时,镀层铜作阳极,镀件铁作阴极,铁应该连接电源负极,电解质溶液为可溶性的铜盐,故C错误;
D.该装置要形成原电池,铁作负极、碳作正极,正极所在的电解质溶液为氯化铁溶液,负极所在溶液为氯化亚铁溶液,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。
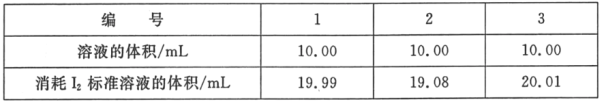
①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成语是中国传统文化的瑰宝。铜墙铁壁、铜心铁胆、金戈铁马、百炼成钢等成语向人传递正能量。工业上,冶炼铁的有关热化学方程式如下:①C(s)+O2(g)=CO2(g) △H1=akJ·mol-1;②CO2(g)+C(s)=2CO(g) △H2=bkJ·mol-1;③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H3=ckJ·mol-1;④2Fe2O3(s)+3C(s)=4Fe(s)+3CO2(g ) △H4=dkJ·mol-1(上述热化学方程式中,a,b,c,d均不等于0)下列说法正确的是
A. b<aB. CO(g)+ 1/2O2(g)= CO2(g) △H<akJ·mol-1
C. d=3c+2bD. C(s)+ 1/2O2(g)=CO (g) △H=(a+b)/2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有VO2+和Cr2O72-,现向其溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好是VO2+→VO2+,Cr2O72-→Cr3+.再滴入2.OOmL0.02000mol/L的KMnO4溶液,又恰好是VO2+→VO2+,而Cr3+不变,此时MnO4-→Mn2+,则原溶液中Cr元素的质量为
A.156 mgB.23 4 mgC.31.2 mgD.46.8mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
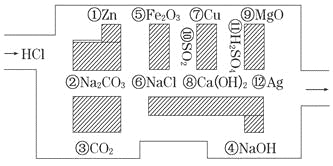
(1)请你帮助它走出迷宫:(请用图中物质前的序号连接起来表示所走的路线)______________。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有______个,属于氧化还原反应的有____个。其中能“吃掉”盐酸的盐是__________(填物质名称),写出该反应的离子方程式_______________;
(3)在不能与盐酸反应的物质中,属于电解质的是___________(填写物质序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,还含有少量SiO2、Fe2O3)为主要原料制备高性能的磁性材料碳酸猛(MnCO3)。其工业流程如图所示,下列说法错误的是
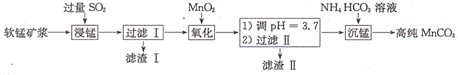
A.滤渣I可用于制造光导纤维、滤渣II可用于制作颜料
B.“浸锰”过程MnO2参与反应的化学方程式为MnO2十SO2=MnSO4
C.“沉锰”时,反应体系的温度越高,越有利于生成MnCO3
D.检验高纯碳酸锰是否洗涤干净,可选用BaCl2溶液和盐酸试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
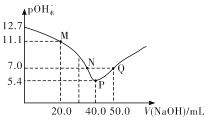
A.水的电离程度:M>PB.图中P点至Q点对应溶液中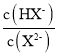 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Al、Fe二种金属元素,下列说法正确的是
A. 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼
B. 等物质的量的Al、Fe分别与足量盐酸反应放出等质量的H2
C. 二者的氢氧化物都不可以通过氧化物化合反应直接制备
D. 二者的单质都能与强碱溶液反应生成H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com