
【题目】氧化镁是优良的阻燃剂,同时在医药、建筑等行业的应用也十分广泛。用硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量SiO2、FeCO3等)为原料制备高纯氧化镁的实验流程如下:

已知在水溶液中生成氢氧化物沉淀的pH:
Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 9.4 | 7.6 | 1.5 |
完全沉淀时 | 10.4 | 9.7 | 2.8 |
(1)菱镁矿酸溶前需要粉碎,目的是_______________。
(2)加入H2O2氧化时,发生反应的离子方程式为______________________。
(3)加氨水调节溶液的pH范围为________ ,滤渣2 的主要成分是____________(填化学式)。
(4)流程图中在获得滤渣2的“过滤”与“煅烧”之间要经过的操作步骤为_______、过滤等操作,得到MgSO4·xH2O晶体。
(5)已知煅烧12.3gMgSO4·xH2O晶体得到2gMgO,则x值为_____________。
【答案】提高酸溶速率 2Fe2++H2O2 + 2H+=2Fe3++ 2H2O 2.8<pH<9.4 Fe(OH)3 蒸发浓缩、冷却结晶 7
【解析】
菱镁矿(主要成分为MgCO3,含少量SiO2、FeCO3等)加入硫酸,碳酸镁和碳酸亚铁溶解生成对应的镁离子和亚铁离子,二氧化硅不溶于硫酸,过滤得到滤渣1为二氧化硅。滤液中加入过氧化氢,氧化亚铁离子生成铁离子,再加入氨水调节溶液的pH,生成氢氧化铁沉淀,过滤得滤渣2为氢氧化铁,滤液经过一系列过程最后煅烧生成氧化镁。
(1)菱镁矿粉碎是为了增大接触面积,提高酸溶速率。
(2)亚铁离子被过氧化氢氧化,离子方程式为:2Fe2++H2O2 + 2H+=2Fe3++ 2H2O;
(3)调节溶液的pH,使铁离子沉淀,但镁离子不能沉淀,根据表格数据分析,pH范围为2.8<pH<9.4,滤渣2的主要成分为 Fe(OH)3。
(4)要得到硫酸镁晶体,需要将滤液进行蒸发浓缩、冷却结晶,过滤,洗涤,干燥得到硫酸镁晶体。
(5) MgSO4·xH2O----MgO
120+18x 40
12.3 2
则有![]() ,计算x=7。
,计算x=7。


科目:高中化学 来源: 题型:
【题目】下列反应既不属于氧化还原反应,又是吸热反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)28H2O与NH4Cl的反应
C. 生石灰与水反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能
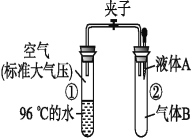
A. NaOH溶液、CO2
B. H2O、氨气
C. NaOH溶液、CO
D. H2O、NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
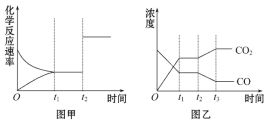
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和氯气,用光照射烧瓶一段时间,下列说法正确的是( )
![]()
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 大试管内的液体可能会分层
D. 向水中加入石蕊试液后不变色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热。
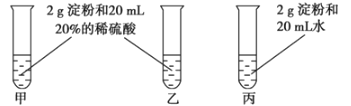
待试管甲中的溶液冷却后再进行后续实验。
实验①:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验②:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验③:取少量丙中溶液加入氢氧化钠溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式_____________________。
(2)设计甲和乙是为了探究________对淀粉水解的影响,设计甲和丙是为了探究________对淀粉水解的影响。
(3)实验①失败的原因是_____________________________。
(4)实验③中溶液的颜色无明显变化的原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com