
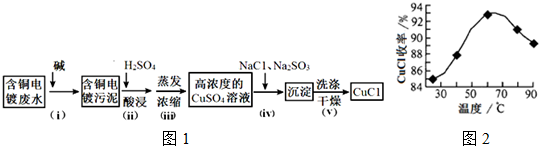
分析 (1)粗铜精炼时,粗铜为阳极,纯铜为阴极;
(2)镀层破损后,内部的铁更容易被腐蚀,形成原电池时Fe为负极;
(3)由制备实验流程可知,步骤i加入碱反应后得到含铜的污泥,过滤分离出污泥,再加硫酸溶解含铜的污泥,得到硫酸铜溶液,蒸发浓缩得到高浓度的硫酸铜溶液,由反应物、生成物可知,步骤ⅳ发生2CuSO4+Na2SO3+2NaC1+H2O=2CuC1↓+2Na2SO4+H2SO4,过滤、洗涤、干燥得到CuCl,以此来解答.
解答 解:(1)粗铜精炼时,粗铜为阳极,失去电子,而阴极上铜离子得到电子生成Cu,故答案为:粗铜;
(2)在铁的表面镀上铜可防止铁被腐蚀,但镀层破损后,内部的铁更容易被腐蚀,其原因是铜镀层破损后,铁与铜在空气中形成原电池,铁比铜活泼,铁做负极,腐蚀加快,故答案为:铜镀层破损后,铁与铜在空气中形成原电池,铁比铜活泼,铁做负极,腐蚀加快;
(3)由制备实验流程可知,步骤i加入碱反应后得到含铜的污泥,过滤分离出污泥,再加硫酸溶解含铜的污泥,得到硫酸铜溶液,蒸发浓缩得到高浓度的硫酸铜溶液,由反应物、生成物可知,步骤ⅳ发生2CuSO4+Na2SO3+2NaC1+H2O=2CuC1↓+2Na2SO4+H2SO4,过滤、洗涤、干燥得到CuCl,
①由上述分析可知,步骤i中操作分离污泥与溶液,则为过滤操作,故答案为:过滤;
②步骤 ii中硫酸溶解污泥,则离子反应为Cu(OH)2+2H+=Cu2++2H2O,故答案为:Cu(OH)2+2H+=Cu2++2H2O;
③步骤ⅳ反应的化学方程式为2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4,故答案为:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4;
④A.由图中30℃升高为60℃可知,CuCl平衡收率增大,则该反应△H>0,故A错误;
B.随着反应温度升高,会加剧Na2SO3分解生成X、Y两种化合物,X为Na2S,则Y一定是Na2SO4,为歧化反应,故B正确;
C.发生4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl,CuCl在潮湿空气中被氧化,故C错误;
D.由图可知,因在60℃时CuCl产率最大,则该条件下,温度最好控制在60~70°C范围,故D正确;
故答案为:BD.
点评 本题考查制备实验的设计及电化学应用,为高频考点,把握制备实验流程中的反应及混合物分离方法、电化学原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中所含的分子数为0.5NA | |
| B. | 标准状况下,22.4L O2与44.8L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1mol的H3O+和OH-中含有的电子数目均为0.9NA | |
| D. | 2.4g O2和O3的组成的混合气体中所含的氧原子数目为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| B. | △H1=+178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| D. | △H1=+178.32kJ•mol-1△H2=+78.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
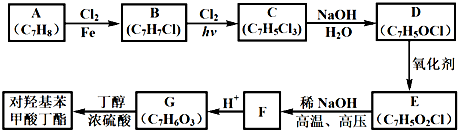
 .
.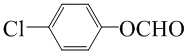 (写一种结构简式)
(写一种结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com