
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
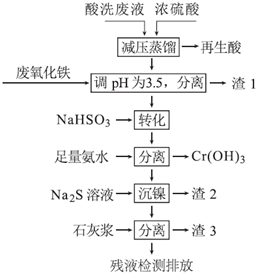
分析 酸洗废液中含有Fe3+、Ni2+、NO3-、F-和+6价铬的含氧酸根离子等,加入浓硫酸减压蒸馏减少硝酸分解,得到再生酸,在溶液中加入废氧化铁调节溶液PH=3.5,使铁离子全部沉淀,过滤得到滤渣Ⅰ,滤液中加入NaHSO3与Cr2O72-发生反应收藏铬离子,加入足量氨水沉淀铬离子形成氢氧化铬沉淀,过滤后的滤液中加入Na2S沉淀镍,过滤得到滤液中加入石灰浆沉淀得到滤渣3CaF2、Ca(OH)2和CaSO4,
(1)分析可知再生酸是难挥发性的浓硫酸反应后生成易挥发性的硝酸和弱酸HF;
(2)废物利用,提高经济效益;
(3)转化时NaHSO3与Cr2O72-发生氧化还原,反应生成铬离子=硫酸根离子和水;
(4)Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+,加入Na2S会生成更难溶的NiS;
(5)分析可知滤渣3为生成的CaF2沉淀,微溶于水的氢氧化钙和硫酸钙;
(6)依据溶度积常数计算F-离子浓度,依据国家排放标准要求氟离子浓度小于10mg•L-1分析判断;
解答 解:酸洗废液中含有Fe3+、Ni2+、NO3-、F-和+6价铬的含氧酸根离子等,加入浓硫酸减压蒸馏减少硝酸分解,得到再生酸,在溶液中加入废氧化铁调节溶液PH=3.5,使铁离子全部沉淀,过滤得到滤渣Ⅰ,滤液中加入NaHSO3与Cr2O72-发生反应收藏铬离子,加入足量氨水沉淀铬离子形成氢氧化铬沉淀,过滤后的滤液中加入Na2S沉淀镍,过滤得到滤液中加入石灰浆沉淀得到滤渣3CaF2、Ca(OH)2和CaSO4,
(1)分析可知再生酸是硝酸根离子和难挥发性的浓硫酸反应后生成易挥发性的硝酸,F-离子结合氢离子生成弱酸HF,再生酸为HNO3、HF,采取减压蒸馏的原因是降低蒸馏的温度以减少硝酸的分解,
故答案为:硝酸、氢氟酸;降低蒸馏的温度以减少硝酸的分解;
(2)利用废氧化铁(主要成分为Fe3O4)代替烧碱调节pH的好处是废物利用,提高经济效益,降低生产成本,
故答案为:废物利用,降低生产成本;
(3)转化时NaHSO3与Cr2O72-发生氧化还原,反应生成铬离子、硫酸根离子和水,反应的离子方程式为:Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O,
故答案为:Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O;
(4)Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+,加入Na2S会生成更难溶的NiS,“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3,
故答案为:[Ni(NH3)6]2++S2-=NiS↓+6NH3;
(5)分析可知滤渣3为生成的CaF2沉淀,微溶于水的氢氧化钙和硫酸钙,滤渣3的主要成分为CaF2、Ca(OH)2和CaSO4,
故答案为:CaSO4;
(6)依据溶度积常数计算F-离子浓度,Ksp=c(Ca2+)c(F-)2=4×10-11 mol3•L-3,残液中c(Ca2+)=0.004mol•L-1,则c(F-)=$\frac{4×1{0}^{-11}}{0.004}$=1×10-4mol/L=1×10-4mol/L×19g/mol=0.0019g/L=1.9mg/L,依据国家排放标准要求氟离子浓度小于10mg•L-1分析判断1.9mg/L<10mg•L-1,符合国家标准,
故答案为:1.9,符合;
点评 本题考查了物质的分离和提纯方法分析、实验基本操作的理解应用,主要是离子分离方法和条件的判断,掌握基础是解题关键,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 L苯所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,22.4 LC2H4的质量为28克 | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
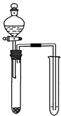 | 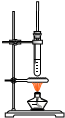 |  |  |
| A.证明酸性: 醋酸>碳酸>苯酚 | B.制备乙酸丁酯 | C.苯萃取碘水中I2,分出水层后的操作 | D.用NH4Cl饱和溶液制备NH4Cl晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
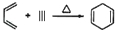 ,如果要合成
,如果要合成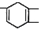 ,所用的起始原料可以是( )
,所用的起始原料可以是( )| A. | CH2=C(CH3)CH=CH2和CH≡C-CH2CH3 | B. | CH2=CHCH=CHCH3和CH3C≡CCH3 | ||
| C. | CH2=C(CH3)C(CH3)=CHCH3和CH≡CH | D. | CH2=C(CH3) C(CH3)=CH2和CH3C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用MnO2和稀盐酸共热来制取氯气 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 在氧化还原反应中,Cl2只能作氧化剂 | |
| D. | 若含0.4 mol HCl的浓盐酸,MnO2过量,可制得标准状况下氯气2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(D)的原子核外有2个电子 | |
| B. | 1H与D是同一种原子 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H${\;}_{2}^{18}$O与D${\;}_{2}^{16}$O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
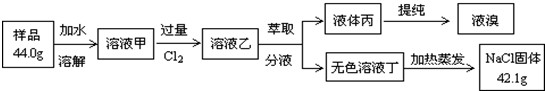
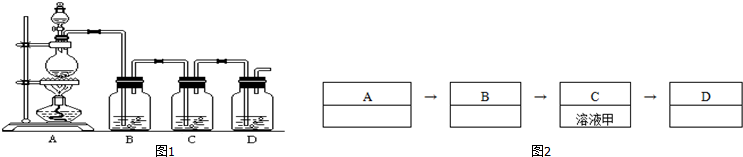
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com