
| A. | 负极发生的反应为Fe-2e-=Fe3+ | |
| B. | 正极发生的反应为2H2O+O2+4e-=4OH- | |
| C. | Cl-向负极迁移 | |
| D. | 铁锈是Fe(OH)3 |
分析 钢铁中含C单质,故在铁板上滴加氯化钠溶液时,则发生电化学腐蚀中的吸氧腐蚀,负极上铁放电:Fe-2e-=Fe2+,正极上氧气放电:O2+4e-+2H2O=4OH-,总反应为:2Fe+O2+2H2O=2Fe(OH)2,由于Fe(OH)2有很强的还原性,故能被氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3,后分解:2Fe(OH)3=Fe2O3•xH2O+(3-x)H2O,得到铁锈Fe2O3•xH2O.据此分析.
解答 解:钢铁中含C单质,故在铁板上滴加氯化钠溶液时,则发生电化学腐蚀中的吸氧腐蚀,负极上铁放电:Fe-2e-=Fe2+,正极上氧气放电:O2+4e-+2H2O=4OH-,总反应为:2Fe+O2+2H2O=2Fe(OH)2,由于Fe(OH)2有很强的还原性,故能被氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3,后分解:2Fe(OH)3=Fe2O3•xH2O+(3-x)H2O,得到铁锈Fe2O3•xH2O.
A、负极反应为Fe-2e-=Fe2+,故A错误;
B、正极反应为O2+4e-+2H2O=4OH-,故B正确;
C、氯离子移向负极,故C正确;
D、铁锈为Fe2O3•xH2O,故D错误.
故选BC.
点评 本题考查了钢铁的电化学腐蚀中的吸氧腐蚀,难度不大,应注意的是负极反应生成亚铁离子.


科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: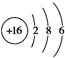 | |
| C. | 原子核内有18个中子的氯分子${\;}_{17}^{35}$Cl2 | |
| D. | CS2分子的结构式:S-C-S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 氯化铝溶液和过量氨水反应:Al3++3NH3•H2O═3NH4++Al (OH)3↓ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从溴水中提取单质溴时,不能用无水乙醇代替CCl4 | |
| B. | 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 | |
| C. | 用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 | |
| D. | 纸层析实验中,不能将滤纸上的试样点浸入展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 贝采里乌斯打破了无机物和有机物的界限 | |
| B. | 苯丙氨酸可以与NaOH溶液或HCl溶液反应形成内盐,内盐的形成是由氢键所致 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 李比希法、钠融法、铜丝燃烧法、元素分析仪均可帮助人们确定有机化合物的元素组成和空间结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 负极为Fe,正极为C,电解质为Fe(NO3)2溶液 | |
| C. | 正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 | |
| D. | 负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com