
(1)已知:①Fe(s)+1/2O2(g)=FeO(s) △H1=-272.0KJ·mol-1
②2Al(s)+3/2(g)=Al2O3(s) △H2=-1675.7KJ·mol-1
Al和FeO发生铝热反应的热化学方程式是__ __。
某同学认为,铝热反应可用于工业炼铁,你的判断是_ (填“能”或“不能”),你的理由

(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A.B,如图所示。①据图判断该反应是 (填“吸”或“放” )热反应,当反应达到平衡后,其他条件不变,,升高温度,反应物的转化率将 (填“增大”、 “减小”或“不变”)。
②其中B历程表明此反应采用的条件为
(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(1)2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1。不能,该反应需要引发,需要消耗大量能量(2)①吸;减小;②D
【解析】
试题分析::(1)①Fe(s)+1/2O2(g)=FeO(s) △H1=-272.0KJ·mol-1;②2Al(s)+3/2(g)=Al2O3(s) △H2=-1675.7KJ·mol-1;依据盖斯定律②-①×3得到热化学方程式为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ•mol-1。(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向逆反应方向移动,反应物的转化率减小,故答案为:吸;减小;②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂,故答案为:D;
考点:本题考查了本题考查了盖斯定律的应用,热化学方程式的书写方法、化学平衡常数、平衡移动题,注意焓变计算应和化学方程式的系数对应,物质聚集状态的标注。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
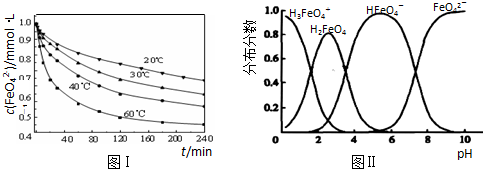
| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
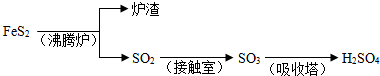
| 1 |
| 2 |
| ||
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
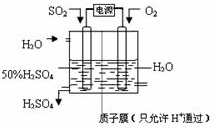
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省潮州市潮安县松昌中学高二(上)期中化学试卷(解析版) 题型:解答题
 O2(g)=FeO(s)△H=-272.0kJ?mol-1
O2(g)=FeO(s)△H=-272.0kJ?mol-1 O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1
O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com