
| A、测得其pH=7 |
| B、电解时得到H2与O2的体积比为2:1 |
| C、遇钠生成氢气 |
| D、1.01×105Pa时沸点为100℃ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B、浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| C、常温下,金属铁遇浓硫酸时会在表面生成致密的氧化膜而发生钝化 |
| D、50mL 18mol?L-1硫酸中加入足量的铜粉反应放出二氧化硫气体少于10.08L |
查看答案和解析>>
科目:高中化学 来源: 题型:
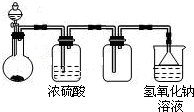
| A、浓氨水与氧化钙固体反应制氨气 |
| B、稀硫酸与硫化亚铁固体反应制硫化氢 |
| C、浓盐酸与次氯酸钙固体反应制氯气 |
| D、饱和食盐水与电石反应制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过量氨水除去Al3+溶液中的少量Fe3+ |
| B、将混合气体通过灼热的铜网除去N2中的少量O2 |
| C、向某溶液中加HCl酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定含有SO42- |
| D、向澄清石灰水中通入少量气体产生沉淀,过量时沉淀溶解,说明该气体一定是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,将5.6L的O2和5.6LNO的混合后的分子数约为0.5NA |
| B、2L 0.5mol/L BaCl2溶液中,阳离子所带电荷数为 NA |
| C、常温常压下,将0.2mol铝片投入含0.6molH2SO4的浓硫酸中,生成0.3 NA个SO2分子 |
| D、42g丙烯气体中,含有的σ键数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
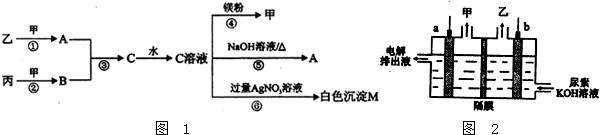
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| A、使用催化剂是为了加快反应速率 |
| B、增大O2浓度可以使SO2转化率达到100% |
| C、加压可以增大反应速率 |
| D、增大O2浓度可以增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com