
【题目】四种短周期元素 W、X、Y、Z,原子序数依次增大,请回答下列问题。

(1)Z 在元素周期表中位于_____族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学 反应,该元素是_____(填元素符号).
(3)① 下列可作为比较 X 和 Y 金属性强弱的依据是_____(填序号).
a.自然界中的含量 b.单质与酸反应时失去的电子数
c.单质与水反应的难易程度 d.最高价氧化物对应水化物的碱性
② 从原子结构的角度解释 X 的金属性强于 Y 的原因:_____,原子半径 X>Y,所以原子核 对最外层电子的吸引力 X失电子能力 X>Y.
(4)W 的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与 X 的最高 价氧化物对应的水化物混合,反应的化学方程式是_____。
(5)Y 单质和 Mg 组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中 Y 的质量分数的数据有_____(填序号).
a. m、n b. m、y c. n、y
【答案】ⅣA Na cd 电子层数相同,质子数 Y > X HN3+NaOH=NaN3+H2O abc
【解析】
四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素。
(1)Z是Si元素,最外层电子数为4,处于第ⅣA族,故答案为:ⅣA;
(2)W形成的最高价氧化物的水化物是硝酸,X的最高价氧化物的水化物是氢氧化钠,Y的最高价氧化物的水化物是氢氧化铝,Z的最高价氧化物的水化物是硅酸,氢氧化钠和其他三种物质能反应,所以该元素是Na,故答案为:Na;
(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度、形成的氯化物溶液酸性强弱等,与得失电子数目多少无关,故选:cd;
②电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,因此Na 的金属性强于 Al,故答案为:电子层数相同,质子数 Y > X;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,反应方程式为:HN3+NaOH═NaN3+H2O,故答案为:HN3+NaOH═NaN3+H2O;
(5)镁、铝和稀硫酸反应生成硫酸镁、硫酸铝和氢气,硫酸镁、硫酸铝和氢氧化钠溶液反应生成氢氧化镁、氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠,氢氧化镁和氢氧化钠溶液不反应,灼烧氢氧化镁固体,氢氧化镁分解生成氧化镁和水,所以最后所得固体是氧化镁。a.根据n的量计算镁的质量,根据m、n计算铝质量,从而计算铝的质量分数,故正确;b.根据镁、铝的质量及镁铝和稀硫酸反应生成氢气的量计算铝和镁质量,从而计算铝的质量分数,故正确;c.根据n的质量计算镁的质量,根据镁的量计算镁和稀硫酸反应生成氢气的量,从而得出铝和稀硫酸反应生成氢气的量,故而得出铝的质量分数,故正确,故选abc。


科目:高中化学 来源: 题型:
【题目】把下列四种X溶液分别迅速加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时,X和盐酸立刻进行反应,其中初始反应速率最快的是
A. 10℃ 10 mL 3 mol·L-1的X溶液 B. 20℃ 10 mL 2 mol·L-1的X溶液
C. 20℃ 10 mL 4 mol·L-1的X溶液 D. 10℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )
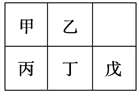
A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
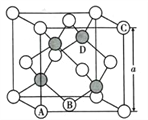
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝热剂的有关叙述中正确的是( )
A.氧化铝和铁的混合物是铝热剂
B.利用铝热反应,常用于冶炼高熔点的金属
C.铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以铝热反应是吸热反应
D.工业上常用铝热反应来大量冶炼金属铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸亚铁、硫酸铁和硫酸铜溶液中加入铁粉,充分反应后,滤出的不溶物除铜粉外,尚有少量铁粉,那么在滤液中( )
A.肯定有Fe2+ , 可能有Fe3+
B.只有Fe2+ , 没有Fe3+和Cu2+
C.可能有Fe3+ , 可能有Cu2+
D.肯定有Fe2+ , 可能有Fe3+、Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com