
分析 (1)根据化合价代数和为0计算;
(2)Cu元素化合价部分由+1价降低到0价,被还原,CuI为氧化剂,Cu是还原产物,计算生成Cu的物质的量,根据Cu元素化合价变化计算转移电子;
(3)从电荷守恒和电子守恒的角度配平离子方程式;
(4)根据氧化还原反应中元素化合价的升降相等判断;
根据还原剂的还原性大于还原产物的还原性进行判断.
解答 解:(1)Cu2HgI4中,Hg元素显+2价,I元素显-1价,设Cu2HgI4中铜元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x×2+(+2)+(-1)×4=0,则x=+1价;
故答案为:+1;
(2)在反应4CuI+Hg═Cu2HgI4+2Cu中,CuI中Cu元素的化合价由+1价降为0价,为氧化剂,Cu是还原产物,2molCuI参加反应生成Cu的物质的量为1mol,则转移电子为1mol,
故答案为:CuI;Cu;1;
(3)Cu2+与I-直接反应制得CuI的反应中,得电子,Cu化合价由+2价降为+1价,失电子,I化合价由-1价升高为0价,根据氧化还原反应氧化剂和还原剂得失电子数目相等,则有2molCu2+参加反应生成1molI3-,反应的离子方程式为2Cu2++5I-=2CuI+I3-,
故答案为:2Cu2++5I-=2CuI+I3-;
(4)②中N元素化合价只升高,不符合氧化还原反应的原理,一定不能发生;在反应①NO+HNO3→N2O3+H2O中NO作还原剂,反应中NO的还原性最强,
故答案为:②;NO.
点评 本题考查氧化还原反应基本概念、配平、计算等,侧重于学生的分析能力的考查,注意从化合价的变化角度理解有关概念,难度不大


科目:高中化学 来源: 题型:解答题
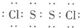 ,其晶体类型为分子晶体.
,其晶体类型为分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥的pH试纸测定新制氯水的pH | |
| B. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
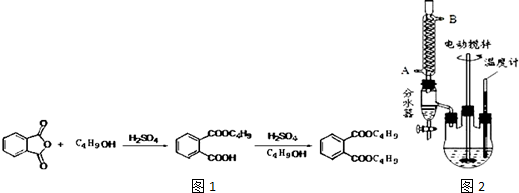
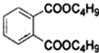 +2NaOH$\stackrel{加热}{→}$
+2NaOH$\stackrel{加热}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-) | |
| B. | 浓度均为0.1 mol/L的 ①NH4Cl ②NH4HSO4③NH4HCO3三种溶液,其中c(NH4+):③>①>② | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 0.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
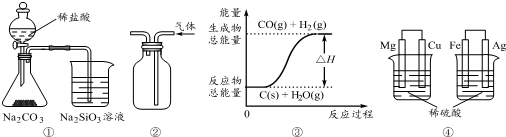
| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集NO2气体 | |
| C. | 图③表示可逆反应C(s)+H2O(g)?CO(g)+H2(g)的△H小于0 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com