
【题目】三草酸合铁(Ⅲ)酸钾制备流程如图所示,下列有关说法不正确的是( )
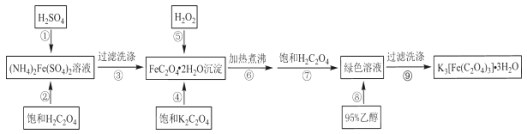
A.在步骤①中加入少量硫酸的目的是防止硫酸亚铁铵的水解,提高草酸亚铁的纯度
B.FeC2O42H2O转化为绿色溶液的离子方程式为:2FeC2O42H2O+H2O2+3C2O42-+H2C2O4=2[Fe(C2O4)3]3-+3H2O
C.在步骤⑥中加热煮沸的目的是为了加快H2O2将亚铁充分氧化为三价铁
D.步骤③与⑨洗涤沉淀的洗涤剂分别可为蒸馏水、无水乙醇
【答案】C
【解析】
将硫酸亚铁铵溶于水形成溶液,在溶液中加入硫酸酸化,防止Fe2+水解,边搅拌边加入草酸溶液,沉淀完全后过滤可得草酸亚铁沉淀,洗涤后项沉淀中加入饱和草酸钾溶液和H2O2,发生反应,此时溶液变成绿色并有棕色沉淀生成,加热煮沸一段时间后,再加入饱和草酸溶液,棕色沉淀溶解,溶液变为绿色透明,先溶液中加入乙醇,结晶完全后过滤,洗涤晶体,即可得三草酸合铁酸钾。
A. 在步骤①中加入少量硫酸和草酸与硫酸亚铁铵反应生成草酸亚铁晶体,加入稀硫酸的目的是防止硫酸亚铁铵的水解,提高草酸亚铁的纯度,A项正确,不符合题意;
B. 由绿色溶液加入95%的乙醇洗涤后得到三草酸合铁(Ⅲ)酸钾晶体可知,FeC2O4·2H2O转化为绿色溶液是过氧化氢氧化,离子方程式为:2FeC2O4·2H2O+H2O2+3C2O42-+H2C2O4=2[Fe(C2O4)3]3-+3H2O,B项正确,不符合题意;
C. 在步骤⑥中加热煮沸的目的是除去溶液中过量的过氧化氢以及溶解的氧气,C项错误,符合题意;
D. 由流程可知FeC2O4·2H2O难溶于水,三草酸合铁(Ⅲ)酸钾晶体难溶于乙醇,步骤③与⑨洗涤沉淀的洗涤剂分别可为蒸馏水、无水乙醇,D项正确,不符合题意;
答案选C。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为两套实验装置。
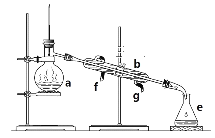
(1)写出下列仪器的名称:
a.__________________
b.__________________
(2)若利用装置I分离四氯化碳和酒精的混合物还缺少的仪器是__________,将仪器补充完整后进行实验。冷凝水由________(填f或g)口通入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个容积相同的密闭容器,甲容器中充入N2和CO的混合气体,乙容器中充入O2,当它们的温度和密度都相同时,下列说法中正确的是
A.两容器中气体的压强相等
B.甲容器中气体的平均摩尔质量与乙容器中气体的摩尔质量相等
C.甲乙两容器气体的质量相等
D.甲乙两容器气体所含原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)在医药和染料生产中有广泛应用。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
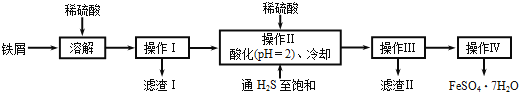
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是__;通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2+等杂质离子;②___。
(2)操作Ⅳ的顺序依次为:___、冷却结晶、___。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100molL-1KMnO4溶液滴定至终点,消耗KMnO4,溶液体积的平均值为20.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)则上述样品中FeSO47H2O的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。已知:25℃H2S电离常数分别为Ka1=1.3×10—7,Ka2=7.0×10—15,某溶液含0.02mol/LMn2+、0.1mol/LH2S,向该溶液中通入HCl气体或加入NaOH固体以调节溶液pH,(忽略溶液体积的变化、H2S的挥发)。当溶液的pH=5时,Mn2+开始沉淀为MnS,则:
(1)HS—的电离常数表达式为______________;
(2)Na2S溶液中的微粒有_____________种;
(3)NaHS溶液的pH_____________7(填“>”、“=”或“<”),理由是__________________;
(4)当溶液的pH=5时,c(S2—)∶c(H2S)=______________;
(5)MnS的溶度积为_____________;
(6)当Mn2+完全沉淀时,溶液中c(S2—)=____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
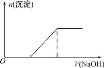
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe2+、NO3-、H+都可在该物质的溶液中大量共存
B.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
C.向0.1molL-1该物质的溶液中逐滴滴加0.1molL-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示
D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A. 0.1 mol L1的盐酸15 mL B. 0.2 mol L1的盐酸12 mL
C. 0.15 mol L1的硫酸溶液8 mL D. 18 mol L1的浓硫酸15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示。
![]()
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
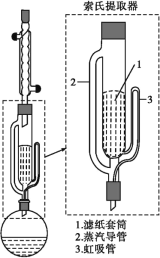
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是___。圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒___。
(2)提取过程不可选用明火直接加热,原因是___。与常规的萃取相比,采用索氏提取器的优点是___。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是___。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有___(填标号)。
A.直形冷凝管 B.球形冷凝管 C.接收瓶 D.烧杯
(4)浓缩液加生石灰的作用是中和___和吸收___。
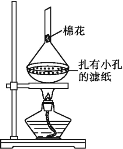
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com