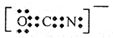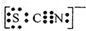分析:A、碳原子与氧原子最外层电子总数多了,二氧化碳分子中碳原子与氧原子之间形成2对共用电子对;
B、过氧化钠是离子化合物,由钠离子与过氧根离子构成;
C、水是共价化合物,分子中氧原子与氢原子之间形成1对共用电子对;
D、氯化镁是离子化合物,由镁离子与氯离子构成,电子式中相同离子不能合并.
解答:解:A、碳原子与氧原子最外层电子总数多了,二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为

,故A错误;
B、过氧化钠是离子化合物,由钠离子与过氧根离子构成,电子式为

,故B错误;
C、水是共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,电子式为

,故C正确;
D、氯化镁是离子化合物,由镁离子与氯离子构成,电子式为
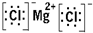
,故D错误.
故选C.
点评:本题考查电子式的书写,难度不大,掌握电子式的书写:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷. 离子化合物电子式的书写,是将阴阳离子(阳离子在前,阴离子在后.)拼在一起.对于不同价态的离子,也按其绝对值,遵照“大值在中间、小值在周边”的原则书写;
以共价键形成的物质,必须正确地表示出共用电子对数,并满足每个原子的稳定结构,共价化合物电子式的书写,一般为正价者在前.对于不同价态的元素的原子,一般将化合价绝对值大的写在中间,绝对值小的写在周边.

 ,故A错误;
,故A错误; ,故B错误;
,故B错误; ,故C正确;
,故C正确;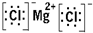 ,故D错误.
,故D错误.

 备战中考寒假系列答案
备战中考寒假系列答案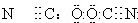 ,则下列电子式正确的是( )
,则下列电子式正确的是( )