
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
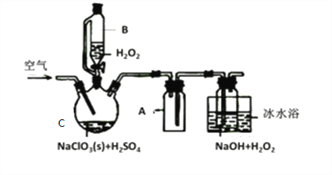
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
【答案】 三颈烧瓶 防止倒吸 降低NaClO2的溶解度 减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解 没有尾气处理装置 空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解 空气流速过快时,ClO2不能被充分吸收,导致浪费原料,产率降低 2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O 当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 90.5%
【解析】(1)仪器C的名称是三颈烧瓶;仪器A为安全瓶,可以防止倒吸;双氧水易分解,ClO2浓度过高时易发生分解,因此冰水浴冷却的目的是为降低NaClO2的溶解度,减少H2O2的分解,增加ClO2的溶解度,减少ClO2的分解。答案为:三颈烧瓶;防止倒吸;降低NaClO2的溶解度 ;减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解
(2)ClO2有毒,污染空气,应该做尾气处理,该装置没有尾气处理装置。答案为:没有尾气处理装置
(3)空气流速过慢时,ClO2不能及时被移走,浓度过高导致ClO2分解;空气流速过快时,ClO2不能被充分吸收,因此空气流速过快或过慢,均降低NaClO2产率。答案为:空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收,导致浪费原料,产率降低
(4)Cl-存在时会催化ClO2的生成,根据第二步反应可知产生氯离子,因此第一步是消耗氯离子,离子方程式为2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O 。答案为:2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O
(5)②有碘单质参与的反应一般采用淀粉溶液为指示剂,因此现象为:当最后一滴滴定液滴下后,溶液由无色变蓝色,且30秒内不褪色。NaClO2和碘化钾反应的离子方程式为ClO2-+4 I-+4 H+= Cl-+2I2+2 H2O根据方程式可以找出一个对应关系即:ClO2-─2I2─4 S2O32-,因为20ml的Na2S2O3溶液中Na2S2O3的物质的量为0.04mol,所以ClO2-的物质的量为![]() ,NaClO2的质量为0.1mol×90.5g/mol=9.05g,故NaClO2的质量分数为
,NaClO2的质量为0.1mol×90.5g/mol=9.05g,故NaClO2的质量分数为![]() .答案为:当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 ,90.5%
.答案为:当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 ,90.5%


科目:高中化学 来源: 题型:
【题目】“冰,水为之,而寒于水”关于水凝结成冰的过程的描述正确的是( )
A. △H > 0 ,△S > 0 B. △H > 0 ,△S < 0
C. △H < 0 ,△S > 0 D. △H < 0 ,△S < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图示与对应的描述相符合的是

A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质碘在水中的溶解度较小,且溶解较慢。实验室配制碘水时,往往将碘单质加入稀KI溶液中。该溶液中存在平衡: ![]() 。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是
。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是

A. 向上述体系中加入CCl4,平衡不移动
B. 25 C时,向上述体系中加入少量I2,平衡向右移动,平衡常数大于680
C. 该反应的平衡常数表达式为
D. 该反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温常压下,1mol SO2的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年6月5日世界环境日主题为“关爱自然,刻不容缓”,人们应具备绿色化学的理念,下列说法错误的是( )
A.尽可能使用无毒无害的原材料
B.尽可能减少生产过程中的能量消耗
C.治理产生的污染优于防治污染的产生
D.尽可能采用对人类和环境低毒或无毒的合成路线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com