
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
分析 (1)食物的酸碱性并非指味觉上的酸碱性,也不是指化学上所指的溶液的酸碱性,而是指食物在体内代谢最终产物的性质来分类;
(2)烟是气溶胶;
(3)若存在简单阴离子R2-,则R一定属于VIA族,简单阴离子最外层电子排布是ns2np6(H元素除外);
(4)硅酸盐中不含二氧化硅;
(5)钢筋属于合金,与海沙混合在一起,容易形成原电池反应而被腐蚀;
(6)浓HNO3的强氧化性.
解答 解:(1)柠檬在人体内代谢后生成碱性物质,使体液呈弱碱性,这类食物习惯上被称为碱性食物,故(1)错误;
(2)烟是气溶胶,“日照香炉生紫烟”是胶体的丁达尔效应,故(2)错误;
(3)简单阴离子最外层电子排布是ns2np6(H元素除外),若存在简单阴离子R2-,说明R元素得2个电子达到稳定结构,所以R一定属于VIA族,故(3)正确;
(4)硅酸盐中不含二氧化硅,所以青石棉中不含石英晶体,故(4)错误;
(5)“海沙危楼”是混凝土中的钢筋与海沙混合在一起,容易形成原电池反应而被腐蚀,故(5)正确;
(6)因浓HNO3具有强氧化性,能够氧化橡皮,所以存放浓HNO3的棕色试剂瓶不用带橡皮塞,而用玻璃塞,故(6)错误;
正确的为(3)(5),
故选A.
点评 本题主要考查了物质性质、物质组成、实验基础知识,化学实验知识比较零碎,要靠平时的点滴积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 104 | C. | 104 | D. | 4×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广“低碳经济”,减少温室气体的排放 | |
| B. | 大力发展新能源,减少化石能源的使用 | |
| C. | 推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 | |
| D. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需要 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
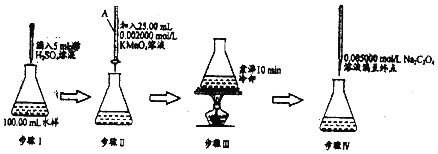
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com