
| A.熔点2 700 ℃,导电性好,延展性强 |
| B.无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂 |
| C.无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电 |
| D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电 |


科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石墨烯属于有机物 | B.该材料吸油过程为物理变化 |
| C.碳纳米管是碳的一种同位素 | D.碳纳米管属于胶体分散系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
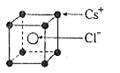
A.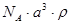 | B. | C.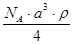 | D.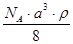 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiO2晶体结构中,每个Si原子与2个O原子直接相连 |
| B.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) |
| C.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| D.1 mol金刚石含4 mol C—C键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol C(金刚石)中含有c—c键数目为2NA |
| B.金刚石与石墨互为同素异形体 |
| C.当有0.4molNa参加反应时,消耗的CO2的体积为6.72L |
| D.3molCO2参加反应时.转移电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
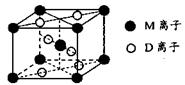
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
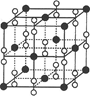
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化钾溶于水时离子键未被破坏 | B.金属晶体中金属键越强,熔点越高 |
| C.冰融化时分子中共价键发生断裂 | D.分子间作用力越大,分子越稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com