
| A. | 与足量Cu共热,转移的电子为ab mol | |
| B. | 常温时加入Al,不会发生化学反应 | |
| C. | 若加入mg Zn片,Zn片完全溶解,可收集到的标准状况下气体体积为22.4m/65 L | |
| D. | 蔗糖与浓硫酸混合,只体现浓硫酸的脱水性 |
分析 A.铜与浓硫酸反应,与稀硫酸不反应;
B.浓硫酸具有强的氧化性,能够使铝钝化;
C.锌与浓硫酸反应生成二氧化硫,与稀硫酸反应生成氢气,依据消耗锌与生成气体量的关系解答;
D.浓硫酸具有脱水性和强氧化性,能将蔗糖中的H、O元素以2:1脱去,将蔗糖氧化为二氧化碳、碳,所以体现了浓硫酸的强氧化性和脱水性.
解答 解:A.随着反应进行浓硫酸浓度降低变为稀硫酸,稀硫酸不与铜反应,所以aL bmol/L的浓硫酸与足量Cu共热,转移的电子小于ab mol,故A错误;
B.浓硫酸具有强的氧化性,能够使铝钝化生成致密氧化膜,有新物质生成属于化学变化,故B错误;
C.锌与浓硫酸反应生成二氧化硫,1mol锌完全反应生成1mol二氧化硫;与稀硫酸反应生成氢气,1mol锌完全反应生成1mol氢气,所以若消耗mg Zn片则生成气体的物质的量为$\frac{m}{65}$mol,标况下气体体积为$\frac{m}{65}$×22.4L,故C正确;
D.浓硫酸具有脱水性和强氧化性,能将蔗糖中的H、O元素以2:1脱去,将蔗糖氧化为二氧化碳、碳,所以体现了浓硫酸的强氧化性和脱水性,故D错误;
故选:C.
点评 本题考查了浓硫酸的性质,根据浓硫酸的脱水性、吸水性、强氧化性来分析解答,注意脱水性和吸水性的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铯的密度比钠大,熔点比钠高 | |
| B. | 氢氧化铯易溶于水 | |
| C. | 铯能与热水反应放出氢气,但与冷水不反应 | |
| D. | 铯与氯形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为液态氨气化时吸热,可用液态氨作制冷剂 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、Cl-、MnO4-、SO42- | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| C. | 加入铝粉能产生氢气的溶液中:CH3COO-、NH4+、SO42-、I- | |
| D. | 使酚酞变红色的溶液:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2和 盐酸; Ba(OH)2 和 H2SO4 | |
| B. | BaCl2 和 Na2SO4; Ba(OH)2 和 (NH4)2SO4 | |
| C. | NaHCO3和 H2SO4; Ca(HCO3)2 和 HNO3 | |
| D. | Ba(OH)2 和 HNO3; Cu(OH)2 和 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑ 阳极:4OH--4e-═O2↑+2H2O | |
| B. | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2↑+2H2O | |
| C. | 阴极:2H++2e-═H2↑ 阳极:2C1--2e-═Cl2↑ | |
| D. | 阴极:Cu2++2e-═Cu 阳极:2C1--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
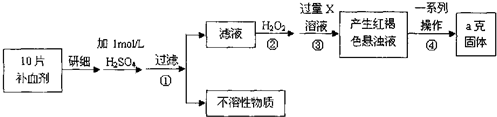
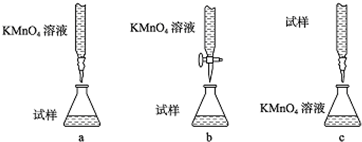
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH和NH4Cl | B. | SO2和SiO2 | C. | MgO和Na2O2 | D. | CCl4和KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com