
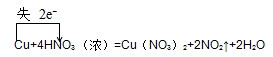 ,该反应的氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;
,该反应的氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;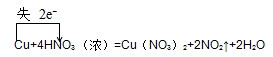 ,当12.8g 即0.2molCu反应时,转移电子是0.4mol,答:电子转移的物质的量是0.4mol.
,当12.8g 即0.2molCu反应时,转移电子是0.4mol,答:电子转移的物质的量是0.4mol.


科目:高中化学 来源: 题型:
| A、氟化氢气体分解生成氢气和氟气的反应是放热反应 |
| B、拆开1molH-H与1molF-F需要的总能量大于生成2molH-F释放的能量 |
| C、在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量 |
| D、1mol H2与1mol F2反应生成2mol液态HF放出的热量等于270kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验步骤 | 简述实验操作 (不必叙述如何组装实验装置) |
| ① | 将粗盐放入烧杯中,加入适时的蒸馏水,充分搅拌,直至固体全部消失 | |
| ② | 加入NaOH溶液 | 逐滴加入氢氧化钠溶液,直至不再出现沉淀为止 |
| ③ | 加入 |
逐滴加入该溶液,直至不再出现沉淀为止 |
| ④ | 加入 |
逐滴加入该溶液,直至不再出现沉淀为止 |
| ⑤ | 过滤 | 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤 |
| ⑥ | 滴加盐酸 | 向滤液中逐滴加入盐酸,并用pH试纸检测溶液,至溶液呈中性 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示:
如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
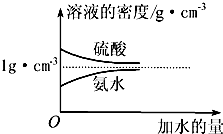 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol?L-1 | 溶质的质量分数 | 溶液的密度/g?cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
| w1 |
| 2 |
| w2 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是
(1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水 |
| B、FeCl3溶液 |
| C、金属钠 |
| D、稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com