
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | SO2与Fe3+反应生成了Fe2+ | |
| 方案③ | 往第二份试液中加入 | SO2与Fe3+反应生成了SO42- |


科目:高中化学 来源: 题型:
A、 往AlCl3溶液中逐滴加入NaOH溶液至过量 |
B、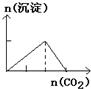 往澄清石灰水中缓慢通入CO2气体至过量 |
C、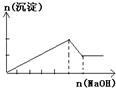 往含MgCl2、AlCl3各1mol的混合溶液中逐滴加入NaOH溶液至过量 |
D、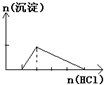 往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
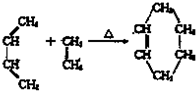
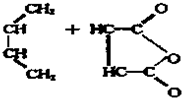
| △ |
| △ |
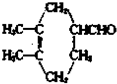
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
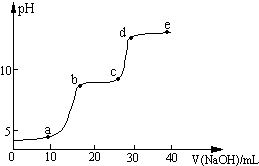 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol?L-1 MgSO4、0.05mol?L-1 Al2(SO4)3的混合溶液中滴加0.5mol?L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、固体混合物中一定含有Al,但质量不可确定 |
| B、固体混合物中一定不含有AlCl3 |
| C、固体混合物中一定含有MgCl2和FeCl2 |
| D、固体混合物中一定含有 (NH4)2SO4和MgCl2,且物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com