
| A. | Na2B溶液存在H2B | |
| B. | NaHB溶液一定显碱性 | |
| C. | NaHB溶液一定显酸性 | |
| D. | NaHB溶液与稀盐酸反应的离子方程式是HB-+H+=H2B |
分析 H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性;任何电解质溶液中都存在电荷守恒和物料守恒,据此分析解答.
解答 解:A.H2B第一步完全电离,所以溶液中没有H2B,故A错误;
B.HB-能电离但不水解,导致溶液中c(H+)>c(OH-),所以溶液呈酸性,故B错误;
C.HB-能电离但不水解,导致溶液中c(H+)>c(OH-),所以溶液呈酸性,其电离方程式为:HB-?H++B2-,故C正确;
D.HB-能电离但不水解,NaHB溶液显酸性,和盐酸之间不会反应,故D错误.
故选C.
点评 本题考查了酸的电离、弱酸部分电离,题目难度不大,注意该酸第一步完全电离、第二步部分电离,导致溶液中不存在H2B,为易错点,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 次氯酸分子的结构式:H-Cl-O | |
| C. | 乙醇的分子式:C2H5OH | |
| D. | 1,1-二溴乙烷的结构简式:CH3CHBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应 | B. | 水解反应 | C. | 加聚反应 | D. | 缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个原子轨道就是电子在原子核外的一个空间运动状态 | |
| B. | 电子云表示处于一定空间运动状态电子在核外空间的概率密度分布的描述 | |
| C. | 原子轨道伸展方向与能量大小是无关的 | |
| D. | 除s电子云外,其他空间运动状态的电子云也可以是球形的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
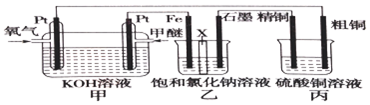
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后容器内的气体只有CO | |
| B. | 反应后生成的CO与反应前的CO2的物质的量之比为1:1 | |
| C. | 反应后生成的CO与反应前的CO2的分子数目之比为3:2 | |
| D. | 反应后容器内的气体与反应前的CO2所含的氧原子数目之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
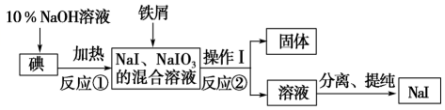
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水煤气只能用作燃料 | |
| B. | 水煤气是一种二级能源,比煤直接燃烧污染小 | |
| C. | 等质量的CO和H2完全燃烧时,前者放热多 | |
| D. | 由③反应可以确定H2的燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com