
【题目】用废雷尼镍(主要成分为NiO、Al,少量Cr、Fe、C、S及有机物)制备Ni(NO3)2·6H2O的实验流程如下:
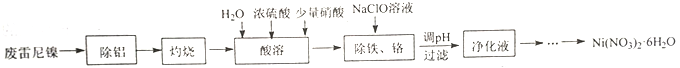
已知:①在实验条件下,Ni2+、Cr3+在溶液中不能被NaClO或HNO3氧化。
②NiSO4易溶于水,NiCO3难溶于水;Ni(NO3)2在20℃、90℃时溶解度依次为79.2、188g/100g水。
③己知“酸溶”后的溶液中主要的四种离子开始沉淀与沉淀完全的pH如下:
Ni2+ | Fe2+ | Fe3+ | Cr3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.5 |
沉淀完全pH | 8.5 | 9.1 | 3.3 | 5.6 |
(1)“除铝”所用试剂及主要操作为__________。
(2)“灼烧”的主要目的是__________。
(3)“酸溶”时,用浓硫酸和水代替稀硫酸的目的是__________。
(4)“除铁、铬”时,Fe2+被氧化为Fe3+的离子方程式为__________;氧化后需将溶液pH调整到的范围是__________。
(5)请设计由“净化液”制取Ni(NO3)2·6H2O的实验方案:__________,离心分离、洗涤、干燥得Ni(NO3)2·6H2O (实验中须使用的试剂有:6mol·L-1硝酸,3 mol·L-1Na2CO3溶液)。
【答案】 用NaOH溶液浸泡、过滤、洗涤及干燥 除去C、S及有机物 利用浓硫酸与水混合放热,使溶液温度升高,加快酸溶速率 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O 5.6<pH<6.2 边搅拌边向“净化液”中滴加3mol·L-1Na2CO3溶液至有大量沉淀,静置,向上层清液中滴加3mol·L-1Na2CO3溶液,若无沉淀,过滤,水洗,向滤渣中加入6mol·L-1硝酸至滤渣恰好溶解,蒸发浓缩、冷却结晶
【解析】(1)“除铝”利用铝能与氢氧化钠溶液反应,而其他物质不与氢氧化钠溶液反应,所用试剂及主要操作为用NaOH溶液浸泡、过滤、洗涤及干燥;(2)“灼烧”的主要目的是除去C、S及有机物;(3)“酸溶”时,用浓硫酸和水代替稀硫酸的目的是利用浓硫酸与水混合放热,使溶液温度升高,加快酸溶速率;(4)“除铁、铬”时,Fe2+被次氯酸钠氧化为Fe3+的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;氧化后需将溶液pH调整使铁离子沉淀完全而铬还没有开始沉淀,则调整到的范围是5.6<pH<6.2;(5)请设计由“净化液”制取Ni(NO3)2·6H2O的实验方案:边搅拌边向“净化液”中滴加3mol·L-1Na2CO3溶液至有大量沉淀,静置,向上层清液中滴加3mol·L-1Na2CO3溶液,若无沉淀,过滤,水洗,向滤渣中加入6mol·L-1硝酸至滤渣恰好溶解,蒸发浓缩、冷却结晶,离心分离、洗涤、干燥得Ni(NO3)2·6H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的说法中,正确的是
A. 热稳定性:Na2CO3<NaHCO3
B. 相同温度下在水中的溶解度:Na2CO3<NaHCO3
C. 取1 mol·L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液
D. 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
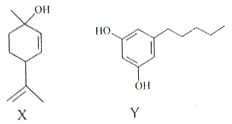
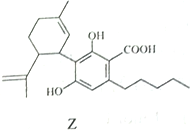
A. X分子中所有碳原子可处于同一平面 B. X、Z分子中均含有2个手性碳原子
C. 1molZ最多只能与2molBr2发生反应 D. X、Y、Z均可与NaOH稀溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下列可用于分离和提纯物质的方法是
(1)除去CaO中混有的CaCO3颗粒____
(2)分离CCl4和水的混合物_____
(3)分离溴水中的溴和水______
(4)除去澄清石灰水中悬浮的CaCO3颗粒______
II、掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:①_____________④______________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器____________;进行I分离操作时进水口为______(填f或g)。
(3)现需配制500mL 0.2 mol/L NaOH溶液,其中装置II是该同学转移溶液的示意图,该同学操作的错误是 _______________;_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托特罗定(G)是毒蕈碱受体拮抗剂,其一种合成路线流程图如下:

(1)C中含氧官能团名称为__________和__________。
(2)D生成E的反应类型为__________。
(3)化合物X的分子式为C9H8O2,写出X的结构简式:__________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________。
能发生水解反应,两种水解产物均能与FeCl3溶液发生显色反应且分子中均只有4种不同化学环境的氢。
(5)已知:R1-CHO![]()
![]() (R1、R2代表烃基或H)
(R1、R2代表烃基或H)
请写出以![]() 、CH3CHO和(CH3)2SO4为原料制备
、CH3CHO和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca10(PO4)6(OH)2(羟基磷酸钙,简写HAP)是一种新型的环境功能矿物材料,可用于除去水体中的F-、Cd2+、Pb2+及Cu2+等。
(1)制备HAP的步骤如下:分别配制250mL浓度均为0.5 mol·L-1的Ca(NO3)2溶液和(NH4)2HPO4溶液(pH约为8),按n(Ca)/n(P)=1.67分别量取相应体积的溶液,加热至50℃,不断搅拌下,按特定的方式加料,强力搅拌1h,再经后续处理得到产品。
①特定的加料方式是__________ (填序号)。
a.将Ca(NO3)2溶液逐滴滴入(NH4)2HPO4溶液中,再用氨水调节pH至10.5
b.将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,再用氨水调节pH至10.5
c.将(NH4)2HPO4溶液和氨水混合并调节pH至10.5,再滴入Ca(NO3)2溶液
②反应生成Ca10(PO4)6(OH)2的离子方程式为__________。
(2)HAP脱除F-的操作是:在聚四氟乙烯烧杯中加入50mL10mg·L-1NaF溶液和0.15gCa10(PO4)6(OH)2,在恒温下振荡,每隔1h测定一次溶液中F-浓度,直至达到吸附平衡。
①实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃,其原因是__________。
②除氟反应形式之一是:Ca10(PO4)6(OH)2+20F-![]() 10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
(3)HAP脱除Pb(Ⅱ)包括物理吸附和溶解-沉淀吸附。物理吸附时,HAP的特定位可吸附溶液中某些阳离子;溶解-沉淀吸附的机理为:
Ca10(PO4)6(OH)2(s)+2H+(aq)![]() 10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Pb2+(aq)+6PO43-(aq)+2H2O(l)![]() Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
已知Pb(Ⅱ)的分布分数如图-1所示;一定条件下HAP对Pb(1)平衡吸附量与pH的关系如图-2所示。
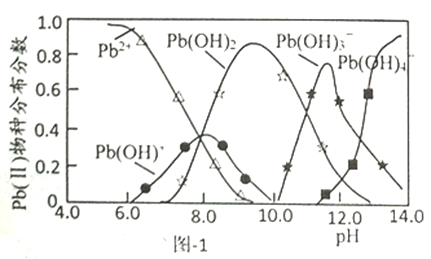
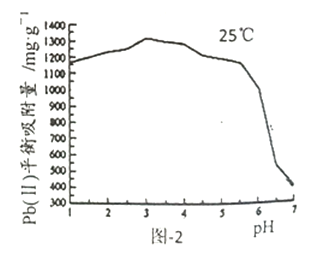
①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应的离子方程式为__________。
②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是__________。
③当pH>7.0时,生成的沉淀为__________(填化学式);此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)不溶于乙醇,20℃、80℃时溶解度依次为70.1、231g/100gH2O。可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4、Na2CO3等)及纯碱等为原料制备Na2S2O3·5H2O的实验流程如下:

(1)用Na2S2O3脱除纸浆中多余Cl2的离子反应方程式为__________。
(2)“净化”时加入的试剂X可能是__________ (填化学式)。
(3)“趁热过滤”时,用双层滤纸过滤的原因是__________。
(4)制备Na2S2O3的实验装置如下图所示:

①装置连接好并装入药品后,检验装置是否漏气的方法是__________。
②实验过程中打开螺旋夹并调节螺旋夹至适当的位置,一方面使反应产生的SO2气体较均匀地通入Na2S-Na2CO3溶液中,另一方面的作用是__________。
③请设计由三口烧瓶中的反应液制备Na2S2O3·5H2O的实验方案:拆解装置,__________,将固体放在40℃烘箱中干燥40min,制得Na2S2O3·5H2O(实验中须使用的试剂有:2mol·L-1NaOH溶液、95%乙醇)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com