
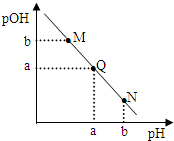
 某温度下,向一定体积的0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的关系如图[已知:pOH=-lgc(OH-)],下列说法正确的是
某温度下,向一定体积的0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的关系如图[已知:pOH=-lgc(OH-)],下列说法正确的是| A、M点溶液导电能力强于Q点溶液导电能力 |
| B、N点所示溶液中,c(CH3COO-)>c(Na+) |
| C、M点与N点所示溶液中水的电离程度相等 |
| D、Q点消耗NaOH溶液体积等于醋酸溶液的体积 |


科目:高中化学 来源: 题型:
 按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体或蒸气可能是(假设每个反应均完全)( )
按照如图装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体或蒸气可能是(假设每个反应均完全)( )| A、CH3CH2OH |
| B、CO或H2 |
| C、NH3 |
| D、C(CH3)3(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和Na2CO3(aq)中通入过量的CO2 |
| B、向饱和的食盐水中加入一小块间质钠 |
| C、向CaCl2(aq)中通入少量的CO2气体 |
| D、向AlCl3(aq)滴入过量稀氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ |
| B、LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 |
| C、镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |
| D、La(NO3)3水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 |
| B、随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 |
| C、Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
| D、稀硝酸和过量铁反应的化学方程式是:Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,C、D,E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )
如图,C、D,E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )| A、若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:02+2H20+4e-=40H- |
| B、欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 |
| C、(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 |
| D、C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤①③④② |
| B、⑤②①③④ |
| C、⑤①④③② |
| D、②⑤①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②④ |
| C、②④⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA |
| B、完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA |
| C、100g 98%的浓硫酸中含氧原子个数为4NA |
| D、1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com