(2013?南昌三模)某兴趣小组挤究SO
2气体还原Fe
3+、I
2,他们使用的药品和装置如下图所示:
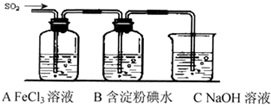
(1)SO
2气体还原Fe
3+反应的产物是
Fe2+
Fe2+
、
SO42-
SO42-
(填离子符号).
(2)下列实验方案可以用于在实验室制取所需SO
2的是
BD
BD
.
A.Na
2SO
3溶液与HNO
3 B.Na
2SO
3固体与浓硫酸 C.固体硫在纯氧中燃烧 D.铜与热浓H
2SO
4(3)装置C的作用是
除去多余的SO2,防止污染空气
除去多余的SO2,防止污染空气
.
(4)如果有280mL SO
2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为
0.25
0.25
mol/L才能达到目的.
(5)在上述装置中通入过量的SO
2为了验证A中SO
2与Fe
3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO
4溶液,紫红色褪去.
方案@:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl
2,产生白色沉淀.
上述方案不合理的是
①
①
,原因是
SO2、Fe2+都能使酸性高锰酸钾褪色
SO2、Fe2+都能使酸性高锰酸钾褪色
.
(6)能表明I
-的还原性弱于SO
2的现象是
B中蓝色褪去
B中蓝色褪去
,写出有关离子方程式:
I2+SO2+2H2O→4H++2I-+SO42-
I2+SO2+2H2O→4H++2I-+SO42-
.




 名校课堂系列答案
名校课堂系列答案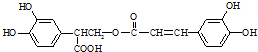 ;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:
;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下: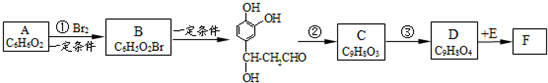
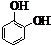

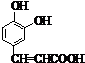

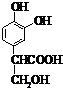
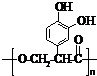 +nH2O
+nH2O
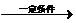
 +nH2O
+nH2O