
科目:高中化学 来源: 题型:解答题
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.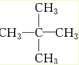 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发法进行海水淡化 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用渗析的方法除去淀粉溶液中含有的少量NaCl | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40K和40Ca原子中的质子数和中子数都不相等 | |
| B. | H2和D2互为同位素 | |
| C. | 互为同位素的原子,它们的原子核内的中子数一定不相等 | |
| D. | 互为同位素的原子,它们原子核内的质子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NPG与乙二醇互为同系物 | |
| B. | 1mol该醇与足量的钠反应放出1mol H2 | |
| C. | NPG一定条件下能发生取代反应、酯化反应、氧化反应、加成反应、加聚反应 | |
| D. | 分子式为C5H12O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、NO3-、Ba2+、Cl- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、NH4+、Cl-、OH- | D. | Na+、K+、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com