
【题目】I.一密封体系中发生下列反应:N2+3H2![]() 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
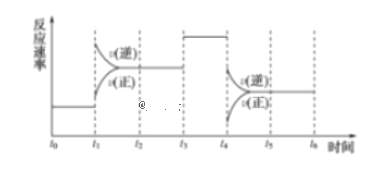
回答下列问题:
(1)处于平衡状态的时间段是___________、___________、___________。
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化:____________、___________、___________。
(3)下列各时间段时,氨的百分含量最高的是___________(填序号)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
II.830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
(4)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
(5)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。
【答案】t0~t1 t2~t4 t5~t6 升高温度 加催化剂 降低压强 A 1 否 大于
【解析】
(1)从平衡状态的本质特征分析,可逆反应达到平衡时,正逆反应速率相等;
(2)根据温度、催化剂以及压强对反应速率的影响分析,注意各时间段正逆反应速率的变化;
(3)随着反应的进行,生成的氨气逐渐增多,氨气的体积分数逐渐增大;
(4)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
(5)计算常数的浓度商Qc、平衡常数,与平衡常数比较判断反应进行方向,据此解答。
(1)从平衡状态的本质特征分析,可逆反应达到平衡时,正逆反应速率相等,时间处于t0~t1,t2~t3,t3~t4,t5~t6时,正逆反应速率相等,则说明反应达到平衡状态,
故答案为:t0~t1,t2~t4,t5~t6;
(2)t1时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动,由反应方程式△H<0可知,应为升高温度;t3时,正逆反应速率都增大并且相等,平衡不移动,应为加入催化剂的变化;t4时,正逆反应速率都减小,且逆反应速率大于正反应速率,平衡向逆反应方向移动,由方程式计量数关系可知,应为减小压强的变化;
故答案为:升高温度;加催化剂;降低压强;
(3)随着反应的进行,生成的氨气逐渐增多,氨气的体积分数逐渐增大,反应进行到最大时间时,生成的氨气最多,氨的体积分数最高,由于t1~t2时间段和t4~t5时间段内,平衡都向逆反应方向移动,氨的百分含量都减小,所以应是t0~t1时间段中氨的百分含量最高,
故答案为:A;
(4)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:

故平衡常数![]() ,
,
故答案为:1;
(5)在相同温度下(850℃),若起始时c(CO)=1molL1,c(H2O)=2molL1,反应进行一段时间后,测得H2的浓度为0.5molL1,则:

浓度商![]() ,故平衡向正反应进行,此时v(正)>v(逆),
,故平衡向正反应进行,此时v(正)>v(逆),
故答案为:否;大于。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:CO和H2在Co做催化剂、温度为160℃~200℃时,可以合成汽油(即分子中含5至8个碳原子的烷烃)。
(1)用CnH2n+2表示汽油,写出上述反应的化学方程式____________________(需配平)
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的![]() ,通过计算说明是否生成汽油__________________。
,通过计算说明是否生成汽油__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如右图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
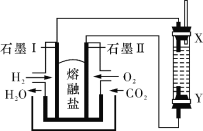
A. 石墨电极Ⅱ处的电极反应式为O2+4e-=2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也互换, 实验方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构体和同系物是两个不同的概念,观察下面列出的几种物质的分子式或结构简式,回答下列问题。
①CO(NH2)2 ②NH4CNO ③CH3CH2CH3 ④CH3CH2CH2CH3 ⑤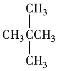 ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)互为同分异构体的是_________;
(2)互为同系物的是___________;
(3)实际上是同种物质的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷的浓硫酸。为研究铁质材料与浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________。
(2)甲同学另称取铁钉10.0 g放入25.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。甲同学认为X中可能含有Fe3+也可能含有Fe2+。若要确认此结论,应用_________选填序号)。
a. KSCN溶液 b. 铁粉和KSCN溶液 c. 氨水 d. 酸性KMnO4溶液
(3)乙同学取448 mL(标准状况)气体Y通入足量溴水中,溴水褪色,发生反应的离子方程式为:______,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为_____。
[探究二]
分析乙同学实验中SO2体积分数的结果,丙同学认为气体Y中除水蒸气外还可能含有Z和W气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
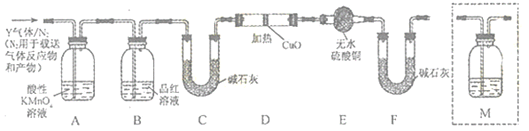
(4)装置B中试剂的作用是____________。
(5)丙同学认为用上图中的D、E、F装置可证明气体Y中还含有Z,则Z气体为_______(化学式),证明Z气体的实验现象为__________;F装置的作用是_________
(6)认为气体Y中还含有W的理由是__________(用化学方程式表示)。为确认W的存在,需在装置中添加M于_______(选填序号)。
a. A之前 b. A-B间 c. B-C间 d. C-D间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3和CO等物质.其中,NO2与SO2都是形成酸雨的主要物质.在一定条件下,两者能发生反应:NO2(g)+SO2(g)SO3(g)+NO(g)
完成下列填空:
(1)在一定条件下,将等物质的量的NO2、SO2气体置于体积固定的密闭容器中发生反应,下列能说明反应已经达到平衡状态的是______.
a.v(NO2)生成=v(SO2)消耗 b.混合物中氧原子个数不再改变
c.容器内气体颜色不再改变 d.容器内气体平均相对分子质量不再改变
(2)当空气中同时存在NO2与SO2时,SO2会更快地转变成H2SO4,其原因是______.
(3)科学家正在研究利用催化技术将NO2和CO转变成无害的CO2和N2,反应的化学方程式:2NO2(g)+4CO(g)![]() 4CO2(g)+N2(g)+Q(Q>0),若在密闭容器中充入NO2和CO,下列措施能提高NO2转化率的是______.
4CO2(g)+N2(g)+Q(Q>0),若在密闭容器中充入NO2和CO,下列措施能提高NO2转化率的是______.
A.选用高效催化剂 B.充入NO2C.降低温度 D.加压
(4)请写出N原子最外层电子轨道表达式______,写出CO2的电子式______.
(5)关于S、N、O、C四种元素的叙述正确的是______.
A.气态氢化物均为极性分子 B.最高化合价均等于原子最外层电子数
C.单质一定为分子晶体 D.原子最外层均有两种不同形状的电子云
(6)写出一个能够比较S元素和C元素非金属性强弱的化学反应方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。
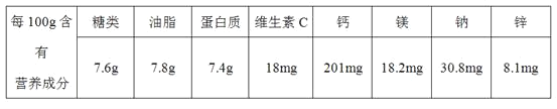
该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com