
| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①②④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | 氢铝化合物可能成为未来的燃料 | |
| B. | Al2H6中含有非极性键 | |
| C. | Al2H6是分子晶体 | |
| D. | Al2H6与水反应生成氢氧化铝和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| B. | ①加入适量的氯化铵晶体后,溶液的pH减小 | |
| C. | ①溶液中c(NH4+)+c(H+)大于④中的c(Cl-)+c(OH-) | |
| D. | VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
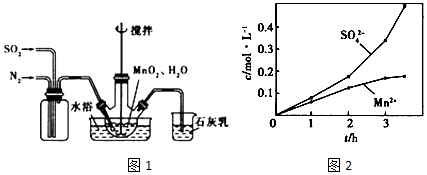
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照 | |
| B. | 无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,不能说明原溶液中一定有SO42- | |
| C. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 | |
| D. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | H2O和D2O互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  利用图所示装置检验溴乙烷发生消去反应,生成乙烯 | |
| B. |  利用图所示装置配置银氨溶液 | |
| C. | 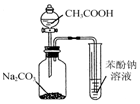 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. | 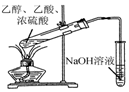 利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com