
【题目】如图所示的图解表示构成细胞的元素、化合物及其作用,a.b.c.d代表不同的小分子物质,A.B.C代表不同的大分子,请分析回答下列问题:
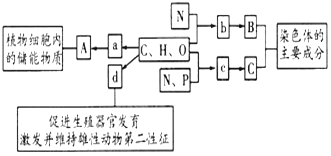
(1)物质a是_______,在动物细胞内,与物质A作用最相近的物质是_______。若物质A在动物、植物细胞均可含有,并作为细胞内的最理想的储存能量的物质,不仅能量多而且体积较小,则A是_________。
(2)物质d是________,化学本质是一种_________。同属于此类的还有胆固醇,其作用是构成__________的重要成分,在人体内还参与_______运输。
(3)物质b是________,若某种B分子含有2条链,由18个b分子(平均相对分子质量为128)组成的组成,则该B分子的相对分子质量大约为__________。
(4)物质c在人体细胞中共有_____种,分子中__________不同,决定了c的种类不同。
【答案】葡萄糖糖原脂肪性激素固醇动物细胞膜脂质氨基酸20164(含氮)碱基
【解析】
分析题图可知,A是植物细胞的储能物质,可能是淀粉或脂肪,B是蛋白质,核糖体由RNA和蛋白质组成,故C是RNA,a是葡萄糖,b是氨基酸,c是核糖核苷酸,d是雄性激素。
(1)由分析可知,A是淀粉,基本组成单位a是葡萄糖,动物细胞中与淀粉相似的物质是糖原。在动物、植物细胞均可含有,并作为细胞内的最理想的储存能量的物质,不仅含能量多而且体积较小的物质是脂肪。
(2)d能促进生殖器官的发育、激发并维持雄性动物的第二性征,所以d是雄性激素。根据固醇包括性激素、维生素D、胆固醇,所以雄性激素属于固醇,其中胆固醇的作用是构成动物细胞膜的重要成分,在人体内还参与脂质运输。
(3)结合前面的分析可知,b是氨基酸。18个b脱水缩合形成2条肽链,脱去的水分子数是16,若某种B分子由18个b分子(平均相对分子质量为128)组成的2条链组成,则该B分子的相对分子质量大约为128×18-16×18=2016。
(4)染色体由蛋白质和DNA构成,c是脱氧核苷酸,因为碱基有A、T、C、G四种,所以c有4种,分子中碱基的不同决定了c的种类不同。


科目:高中化学 来源: 题型:
【题目】已知可逆反应:A(g)+B(g)![]() C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)= 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
【答案】C
【解析】A、Ba(OH)2为强碱,抑制水的电离,Na2C03为强碱弱酸盐,CO32-结合水中的H+,从而促进水的电离,因此Na2C03溶液中水电离的c(OH)大,故A错误;B、溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)=c(Cl-)+c(CH3COO-),c(Na+)>c(Cl-),根据醋酸钠的物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以(Cl-)=c(CH3COOH),c(Na+)>c(Cl-)=c(CH3COOH),故B错误;D、①NH4HCO3中NH4+水解呈酸性,HCO3水解呈碱性,促进NH4+的水解;②NH4HSO4在水溶液中完全电离出H+,抑制NH4+的水解;③NH4Fe(SO4)2中,Fe3+水解呈酸性,但Fe3+水解产生H+的浓度小,它对抑制NH4+的水解抑制程度小;④NH3H2O部分电离,产生的NH4+浓度比盐溶液中的小,故四种溶液中NH4+的浓度:②>③>①>④,故C正确;D、根据电荷守恒NaClO(aq)中c(Na+)+c(H+)=c(OH)+c(ClO),所以NaClO(aq)中离子总浓度为2[c(Na+)+c(H+)];根据电荷守恒NaCl(aq)中离子总浓度也为2[c(Na+)+c(H+)];等浓度的NaClO(aq)与NaCl(aq)中c(Na+)相同,NaClO溶液中ClO-水解,溶液呈碱性,c(OH)>c(H+),c(H+)<![]() ,而NaCl(aq)中,c(OH)=c(H+)=
,而NaCl(aq)中,c(OH)=c(H+)=![]() ,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
【题型】单选题
【结束】
17
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构如下,下列有关X的说法正确的是( )
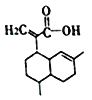
A. X的分子式为C15H24O2
B. 1molX最多可以和3molH2发生加成反应
C. X能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.放热反应的发生均无需加热
B.需要加热后才能发生的反应均是吸热反应
C.伴有能量变化的物质变化都是化学变化
D.物质发生化学反应都伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
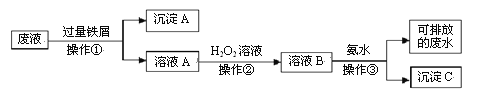
(1)操作①的名称是_____。
(2)沉淀A中含有的金属单质有__________。
(3)操作②中观察到的实验现象是_____________。
(4)检验溶液B中含有的金属阳离子常用的试剂是___________。
(5)操作③中发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水钴矿的主要成分为Co2O3,还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2等。一种利用水钴矿制取CoCl2·6H2O 的工艺流程如下:
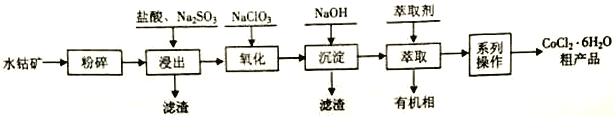
已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 molL-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5molL-1):
沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.4 | 1.5 | 6.3 | 7.0 | 4.7 | 8.1 |
沉淀完全时pH | 4.7 | 2.8 | 8.3 | 9.0 | 6.7 | 10.1 |
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =_______________。
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为_______________________________。
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是______________;氧化工序主要反应的离子方程式为_______________________________。
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:

①浸出温度控制在50-60℃的原因是_________________________。
②应选择萃取剂_________________________(填“A”或“B”)。
(5)“系列操作”依次是____________、______________和过滤等;制得的CoCl2·6H2O需减压烘干的原因是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com