
(17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(1)K12/ K2
(2)2.5×10-2;75%;>;不变;升高温度
(3)c(NO3?) > c(NO2-) > c(CH3COO?);b、c
【解析】
试题分析:(1)设已知的两个反应为①②,则4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)可由2×①—②,则K= K12/ K2
2NaNO3(s)+2NO(g)+Cl2(g)可由2×①—②,则K= K12/ K2
(2)转化的n(Cl2)=1/2×7.5×10-3mol?L-1?min-1×2L×10min=7.5×10-2,则平衡后n(Cl2)=0.1mol—7.5×10-2=2.5×10-2;转化的n(NO)=7.5×10-3mol?L-1?min-1×2L×10min=0.15mol,则NO的转化率а1=0.15mol÷0.2mol×100%=75%;其它条件保持不变,反应(II)在恒压条件下进行,则反应(II)的压强大于反应(I)的压强,则平衡更有利于向右移动,所以平衡时NO的转化率а2 >а1;因为温度不变,所以平衡常数不变;反应(II)?H < 0,为放热反应,所以升高温度,平衡向左移动,K2减小。
(3)根据越弱越水解的规律,CH3COO?水解程度大于NO2-的水解程度,所以离子浓度 由大到小的顺序为:c(NO3?) > c(NO2-) > c(CH3COO?);因为CH3COO?水解程度大于NO2-的水解程度,所以溶液A的pH小于溶液B,向溶液A中加适量NaOH,溶液A的pH增大,向溶液B中加适量水,溶液B的pH减小,故b、c正确。
考点:本题考查反应速率、转化率和平衡常数的计算,化学平衡移动,离子浓度比较。


科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(浙江卷解析版) 题型:选择题
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2 + M = NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH-=6 Ni(OH)2 + NO2-
下列说法正确的是
NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-
充电过程中OH-离子从阳极向阴极迁移
充电过程中阴极的电极反应式:H2O + M + e-= MH + OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:填空题
〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(广东卷解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
C | 将可调高度的铜丝伸入到稀NHO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(山东卷解析版) 题型:填空题
(12分)【化学—有机化学基础】
3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
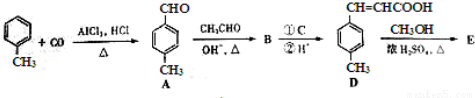
已知:HCHO+CH3CHO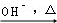 CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有 _________ 种,B中含氧官能团的名称为 _________ .
(2)试剂C可选用下列中的 _________ .
a、溴水
b、银氨溶液
c、酸性KMnO4溶液
d、新制Cu(OH)2悬浊液
(3)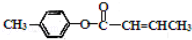 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 _________ .
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 _________ .
(4)E在一定条件下可以生成高聚物F,F的结构简式为 _________ .
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(山东卷解析版) 题型:选择题
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO B. Fe2O3 C. FeSO4 D、Fe3O4
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(安徽卷解析版) 题型:选择题
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是
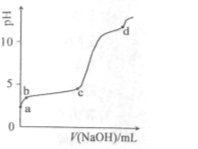
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3++3OH- Al(OH)3
Al(OH)3
B.a→b段,溶液pH增大,Al3+浓度不变
C.b→c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(四川卷解析版) 题型:填空题
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
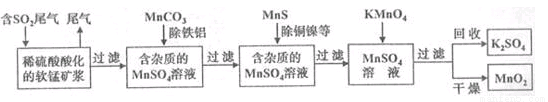
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(上海卷解析版) 题型:选择题
向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸。下列离子方程式与事实不相符的是
A.OH-+CO32-+2H+→HCO3-+H2O B.2OH-+CO32-+3H+→HCO3-+2H2O
C.2OH-+CO32-+4H+→CO2↑+2H2O D.OH-+CO32-+3H+→CO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com