
若不断地升高温度,实现“冰→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用力依次是
A.氢键;分子间作用力;非极性共价键
B.氢键;氢键;极性共价键
C.氢键;极性共价键;分子间作用力
D.分子间作用力;氢键;非极性共价键
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(15分)硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有 。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
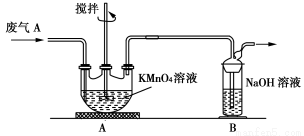
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是 。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4•7H2O)。实验模拟制备皓矾工业流程如下:

①“氧化”中加入硫酸铁发生反应的离子方程式是 。
②加入Zn粉的目的是 。
③固体A主要成分是 。
④操作b得到纯净皓矾晶体,必要的操作是 、 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
金属钠与下列物质的溶液反应,既有沉淀生成又有气体放出的是
A.Mg(NO3)2 B.HNO3 C.Na2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:选择题
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质④不锈钢和目前流通的硬币都是合金⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑥豆浆和雾都是胶体。上述说法正确的是
A.①②④⑤ B.①③④⑥ C.①⑤⑥ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
经分析,某物质只含有一种元素,则该物质
A.一定是纯净物 B.可能是化合物
C.一定是混合物 D.可能是纯净物,也可能是混合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:选择题
向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是: SO42-+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第一次模拟化学试卷(解析版) 题型:填空题
(14分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:(已知:NaCl熔点为801℃;AlCl3在181℃升华)

(1)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有 ,固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(3)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(4)向滤液中通入过量CO2所发生反应的离子方程式为 。
(5)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南洛阳高级中学高二上9月月考化学试卷(解析版) 题型:实验题
(共18分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:
所用酸性KMnO4溶液的浓度可选择0.010 mol·L-1、 0.0010 mol·L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol·L-1)的用量均为2 mL。
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如下,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 。

(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 探究温度对反应速率的影响; c.实验①和 探究催化剂对反应速率的影响。 |
② | ||||
③ | 0.010 | |||
④ |
(3)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次 | 第3次 | |
Ⅰ | 14.0 | 13.0 | 11.0 |
Ⅱ | 6.5 | 6.7 | 6.8 |
① 实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行 (填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:
(5)化学催化剂有很多,在生产和科技领域起到重大作用。探究小组又利用乙装置探究MnO2对H2O2分解的催化效果。将50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如下图所示。
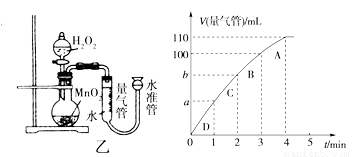
①实验时放出气体的总体积是____ ____mL。
②b______ __(填“大于”“小于”或“等于”)90 mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com