
【题目】用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:①有氧气生成;②____________。Na2O2跟水反应的化学方程式是____________。
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是_________;用以验证第二条结论的实验方法是________。

(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。
(4)将Cl2制成漂白粉的主要目的是________(填字母)。
A.增强漂白能力和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.提高氯的质量分数,有利于漂白、消毒
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的化学方程式为_________。
(6)瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用。试用化学方程式表示漂白粉在空气中易失效的原因是①_____________;②__________。
【答案】该反应是放热反应 2Na2O2+2H2O===4NaOH+O2↑ 关闭止水夹,将带火星的木条靠近导管口p处,木条复燃 反应停止后,将导管口q浸入水中,打开止水夹,q处有气泡冒出 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O B Ca(ClO)2+Na2CO3===CaCO3↓+2NaClO CaCl2+Na2CO3===CaCO3↓+2NaCl Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,说明过氧化钠与水反应放出热量,结合质量守恒定律可知生成NaOH和氧气;
(2)用A图所示装置进行实验,生成氧气具有助燃性,放热使锥形瓶内气体压强增大;
(3)氯气与石灰乳反应会生成氯化钙、次氯酸钙和水;
(4)氯气有毒,气体不方便运输、销售,为了方便人们日常使用和运输,需要制成固体,并减低对人体的毒害;
(5)上层清液中含氯化钙与次氯酸钙,均会与碳酸钠生成碳酸钙沉淀;
(6)次氯酸钙会与空气中二氧化碳与水反应生成易分解的次氯酸。
(1)往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,可知反应生成氧气,且反应放出热量,是放热反应;发生的反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:该反应是放热反应;2Na2O2+2H2O===4NaOH+O2↑;
(2)用A图所示装置进行实验,验证第一条结论的实验方法是关闭止水夹,将带火星的木条靠近导管口p处,木条复燃,用以验证第二条结论的实验方法是反应停止后,将导管口q浸入水中,打开止水夹,q处有气泡冒出
故答案为:关闭止水夹,将带火星的木条靠近导管口p处,木条复燃 反应停止后,将导管口q浸入水中,打开止水夹,q处有气泡冒出;
(3)氯气通入石灰乳[Ca(OH)2]制取漂白粉的化学方程式为:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
(4)A. 将Cl2制成漂粉精,漂白和消毒作用效果不会改变,A项错误;
B. 氯气有毒,气体不方便运输、销售,制成漂粉精是一种较稳定物质,便于保存和运输,B项正确;
C. 将Cl2制成漂粉精是为了将气体转化为固体,便于保存和运输,C项错误;
D. 将Cl2制成漂粉精,其中氯元素的质量不变,漂白和消毒作用效果不会改变,D项错误;
答案选B。
(5)将漂白粉溶于水中,上层清液中会存在钙离子、氯离子和次氯酸根离子,因此滴加碳酸钠溶液出现白色沉淀,发生反应的化学方程式为:Ca(ClO)2+Na2CO3===CaCO3↓+2NaClO;CaCl2+Na2CO3===CaCO3↓+2NaCl;
(6)由于碳酸的酸性强于次氯酸,因此久置的漂白粉会与空气中的二氧化碳和水反应,生成的次氯酸易分解,因此失效,反应的化学方程式为:①Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;② 2HClO![]() 2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;2HClO
2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑。
2HCl+O2↑。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=________kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。

①该反应自发进行的条件是________(填“低温”、“高温”或“任意温度”)
②506K时,反应平衡时H2的转化率为________;压强:p1________(填“>”“<”或“=”)p2。
③反应速率:N点v正(CO)________(填“>”“<”或“=”)M点v逆(CO)。
(4)已知常温下,H2A在水中存在以下平衡:H2A![]() H++HA﹣,HA﹣
H++HA﹣,HA﹣![]() H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
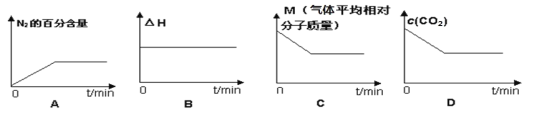
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要配制500 mL 1 mol·L-1硫酸溶液。
(1)需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸________mL。
有如下操作步骤:
①把量好的浓硫酸沿烧杯壁慢慢注入蒸馏水中,并用玻璃棒搅拌溶解。
②把①所得溶液冷却后小心转入500mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(2)操作步骤的正确顺序为______________(填序号)。
(3)本实验必须用到的玻璃仪器有10ml量筒、玻璃棒、烧杯、_________。
(4)下列情况使所配溶液的浓度偏高的是_________
A.某同学观察液面的情况如图所示

B.没有进行操作步骤④;
C.加蒸馏水时不慎超过了刻度线,再吸出一部分水。
D.向容量瓶中转移溶液时(操作步骤②)溶液流到容量瓶外面
(5)若实验过程中出现(4)中D选项情况应如何处理?:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-====4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2====2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com