
【题目】茉莉醛被广泛应用于食品、化妆品和洗涤剂中。实验室制备茉莉醛的反应:![]() +CH3(CH2)5CHO
+CH3(CH2)5CHO![]()
![]() +H2O,有关数据如下表:
+H2O,有关数据如下表:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | |
苯甲醛 | 106 | 1.04 | 179 |
庚醛 | 114 | 0.85 | 153 |
茉莉醛 | 202 | 0.97 | 287 |
实验室制备茉莉醛的装置示意图如下:

实验步骤:
在a中加入5.30 mL苯甲醛、5 mL95%乙醇、12 mL10%KOH溶液,在c中加入6.84 g庚醛。搅拌并加热至60~65℃,打开c向a中缓慢滴加庚醛。保温搅拌反应3 h。反应待冷却后,静置分层,分出有机层,水层用20 mL二氯甲烷分两次萃取,萃取分液后与有机层合并,有机层再用10 mL水洗涤3次,洗涤后加入无水Na2SO4。蒸馏,收集287~290℃馏分,馏分用柱色谱法进行分离,得纯净的茉莉醛4.04g。已知:柱色谱分离中,先将液体样品从柱顶加入,流经吸附柱时,即被吸附在柱的上端,然后从柱顶加入洗脱剂,由于吸附剂对各组分吸附能力不同,各组分以不同速度沿柱下移,从而达到分离的效果。
回答下列问题:
(1)仪器a的名称是___________,实验中应采取的加热方法是___________。
(2)在洗涤操作中,用水洗涤的主要目的是________,加入无水Na2SO4的目的是________。
(3)用二氯甲烷萃取分液时,水层在_____(填“上”或“下”)层。
(4)柱色谱法分离中使用的吸附剂为硅胶或碳酸钙,除此之外,还可以使用_______(填序号)
①活性炭 ②氯化钠 ③氧化铝 ④碳酸钾
(5)柱色谱法分离过程中,如果洗脱剂加入速度太快,会使产品产率_______(填“偏高”、“不变”、“偏低”)
(6)本实验所得茉莉醛产率为______%。
【答案】三颈烧瓶 水浴加热 除去有机产物中的乙醇 干燥 上 ①③ 偏高 38.5
【解析】
本实验的目的是制备茉莉醛,在三颈烧瓶中利用苯甲基、庚醛在碱性环境、水浴加热的条件下制备茉莉醛,乙醇主要是作反应溶剂;之后静置分层,分离出有机层,之后用二氯甲烷两次萃取水层中溶解的少量有机物,并将分液后的有机层与产物中的有机层合并,之后用水洗涤,除去混有的乙醇,加入无水硫酸钠进行干燥,此时产品中的杂质主要为未反应的苯甲醛和庚醛,蒸馏分离得到茉莉醛。
(1)根据仪器a的结构特点可知其为三颈烧瓶;反应所需温度为60~65℃,不超过100℃,所以可以用水浴加热;
(2)水洗可以洗掉某些水溶性杂质,有机层中溶有乙醇杂质,乙醇和水可以互溶,所以用水洗涤的主要目的是除去有机物中的乙醇;无水硫酸钠可以吸收有机层中残留的水分,即目的为干燥;
(3)二氯甲烷的密度比水大,所以分液时水层在上层;
(4)柱色谱法是利用混合物各组分在某一物质中的吸附或溶解性的不同进行物质分离提纯的一种方法,使用的吸附剂一般表面积比较大,且不与分离物发生反应的物质,故可以使用碳酸钙、硅胶、氧化铝、活性炭等,所以选①③;
(5)柱色谱法分离过程中,如果洗脱剂加入速度太快,会导致得到的茉莉醛不纯,从而使测得的产品产率偏高;
(6)加入的苯甲醛的物质的量为![]() =0.052mol,庚醛的物质的量为
=0.052mol,庚醛的物质的量为![]() =0.06mol,所以庚醛过量,所以理论上生成茉莉醛为0.052mol,所以产率为
=0.06mol,所以庚醛过量,所以理论上生成茉莉醛为0.052mol,所以产率为![]() =38.5%。
=38.5%。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质:①.Cu ②.NaCl晶体 ③.NaHSO4 ④.CO2 ⑤.CaO ⑥HCl ⑦.稀H2SO4 ⑧. 熔融Ba(OH)2 ⑨.C2H5OH ⑩.NaCl溶液。
属于电解质的是(填序号,下同)_____,属于非电解质的是_____,能导电的是______。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 ___________________________;
②Al2(SO4)3 ________________________________;
③NH4NO3 ________________________。
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式:__________。
【答案】②③⑤⑥⑧ ④⑨ ①⑦⑧⑩ NaHSO4=Na++H++SO42- Al2(SO4)3=2Al3++3SO42- NH4NO3=NH4++NO3- Cu2++2OH-==Cu(OH)2↓ Na2CO3+2HCl=2NaCl+CO2↑+H2O(或其他)
【解析】
(1)在水溶液里或熔化状态下能够自身电离出离子的化合物是电解质,属于电解质的是NaCl晶体、NaHSO4、CaO、HCl、熔融Ba(OH)2,答案选②③⑤⑥⑧;在水溶液里和熔融状态下都不能自身电离出离子的化合物是非电解质,属于非电解质的是CO2、C2H5OH,答案选④⑨;含有自由移动电子或离子的物质可以导电,能导电的是Cu、稀H2SO4、熔融Ba(OH)2、NaCl溶液,答案选①⑦⑧⑩;(2)①NaHSO4在水溶液中的电离方程式为NaHSO4=Na++H++SO42-;②Al2(SO4)3在水溶液中的电离方程式为Al2(SO4)3=2Al3++3SO42-;③NH4NO3在水溶液中的电离方程式为NH4NO3=NH4++NO3-。(3)①硫酸铜溶液中滴加氢氧化钠溶液生成氢氧化铜沉淀和硫酸钠,反应的离子方程式为Cu2++2OH-==Cu(OH)2↓:②能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式可以是Na2CO3+2HCl=2NaCl+CO2↑+H2O。
点睛:化合物在水溶液中或受热熔化时本身能否发生电离是区别电解质与非电解质的理论依据,能否导电则是实验依据。因此能导电的物质不一定是电解质,如石墨;电解质本身不一定能导电,如NaCl晶体。
【题型】填空题
【结束】
27
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色A________,B____________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A_______________________;A→B____________________________。
(3)B→C可看到的现象是___________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1KOH溶液滴定10.00mL0.10mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积看成两者溶液的体积之和),下列说法正确的是

A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.15mol·L-1
D.点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是

A.E代表CO2, F代表CH4
B.笼状结构中水分子间主要靠氢键结合
C.CO2置换出CH4的过程是化学变化
D.CO2可置换可燃冰中所有的CH4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)的制取原理为:Al2O3+N2+3C=2AlN+3CO↑,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
(1)称取20.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出NH36.72L(标准状况)。AlN与NaOH溶液反应的化学方程式为__________;该样品中的的AlN质量分数为__________。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AlN不跟O2反应),该样品中含杂质炭__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已,知:R-C≡C-H+R'Br ![]() R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式
R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式![]() 。下列说法正确的是
。下列说法正确的是
A. ![]() 和苯乙炔互为同系物
和苯乙炔互为同系物
B. 炔烃和卤代烃在一定条件下可发生取代反应
C. 高分子材料P不能使溴的四氯化碳溶液褪色
D. 生成P的单体是![]() 和CH3Br
和CH3Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
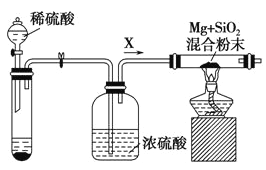
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:

已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com