
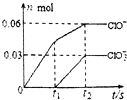
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A. | 苛性钾溶液中KOH的质量是4.94g | |
| B. | 反应中转移电子的物质的量是0.21mol | |
| C. | Cl-的物质的量为0.09mol | |
| D. | ClO${\;}_{3}^{-}$的生成是由于KOH过量引起的 |
分析 氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,结合m=nM计算氢氧化钾质量.
解答 解:氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,
A.通过以上分析知,氢氧化钾的物质的量=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故A错误;
B.该反应中转移电子的物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故B正确;
C.根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故C错误;
D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D错误;
故选B.
点评 本题考查了氧化还原反应的计算,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有一种第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的转化是化学变化 | |
| B. | NO2能与水反应生成硝酸,所以NO2是酸性氧化物 | |
| C. | 铝粉和氧化镁粉末可以组成铝热剂发生铝热反应 | |
| D. | 某元素的气态氢化物能与其最高价氧化物对应的水化物发生化学反应,则该元素一定是N元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表短周期的一部分.回答下列问题:
如表为元素周期表短周期的一部分.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-十H2O═2HCO3- | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+═Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g),△H<O;升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应属于取代反应,有机物的名称是硝基苯.
,该反应属于取代反应,有机物的名称是硝基苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
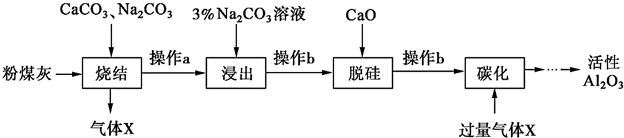
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com